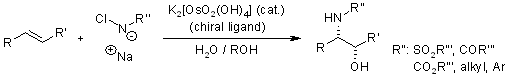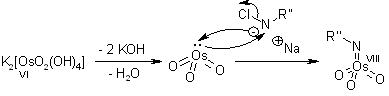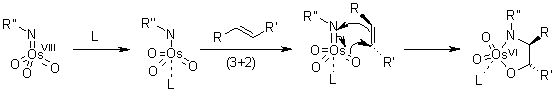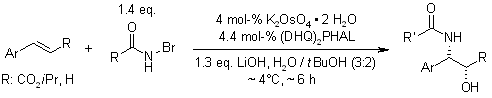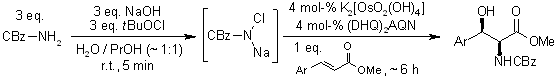quimico
2012-07-15 09:33
K. Barry Sharpless (Philadelphia, Pennsylvania, 1941) è un chimico statunitense, celebre principalmente per tre reazioni enantioselettive:
- diidrossilazione o bisidrossilazione,
- epossidazione,
- aminoidrossilazione o ossiaminazione.
La sua ricerca verte soprattutto su modular click chemistry, in situ click assembly in ospiti biologici, catalizzatori omogenei a base di Os, Ru, & Rh per reazioni di ossidazione e processi asimmetrici catalizzati da metalli di transizione.
Epossidazione
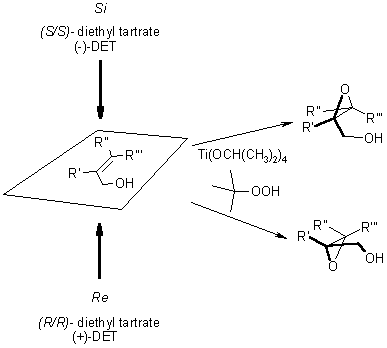
La reazione permette l'epossidazione enantioselettiva di alcoli allilici prochirali. L'induzione asimmetrica è ottenuta aggiungendo un derivato dell'acido tartarico arricchiato enantiomericamente.
Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974.
Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985).
Meccanismo
L'ossidante per l'epossidazione è il tert-butile idroperossido. La reazione è catalizzata da Ti(OiPr)4, che lega l'idroperossido, il gruppo alcolico dell'alcole allilico, ed il ligando tartrato asimmetrico tramite gli atomi di ossigeno (un possibile stato di transizione è riportato sotto).
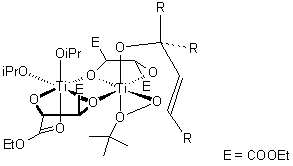
Come è evidente, la stereochimica dell'epossido risultante è determinata dal diastereoisomero del diestere chirale dell'acido tartarico impiegato (di solito dietile tartrato o diisopropile tartrato) nella reazione. È necessario solamente il 5-10 mol% di catalizzatore in presenza di setacci molecolari 3Å (3Å MS).
Gao, Y.; Hanson, R. M.; Klunder, J. M.; Ko, S. Y.; Masamune, H.; Sharpless, K. B. J. Am. Chem. Soc. 1987, 109, 5765-5780.
Cinque sono i motivi per cui questa reazione di epossidazione ha avuto un successo così grande da meritarsi anche il Premio Nobel nel 2001.
Primo, gli epossidi possono essere facilmente convertiti in dioli, aminoalcoli e eteri, così la formazione di epossidi chirali è un passaggio molto importante nella sintesi di prodotti naturali.
Secondo, l'epossidazione di Sharpless reagisce con molti alcoli allilici primari e secondari.
Terzi, i prodotti dell'epossidazione di Sharpless frequentemente hanno eccessi enantiomerici >90%.
Quarto, i prodotti sono prevedibili usando il modello di epossidazione proposto dallo stesso Sharpless.
Infine, i reagenti per l'epossidazione sono disponibili commercialmente e relativamente poco costosi.
Per chi fosse interessato riporto qui alcune reviews:
Johnson, R. A.; Sharpless, K. B. Comp. Org. Syn. 1991, 7, 389-436.
Hüft, E. Top. Curr. Chem. 1993, 164, 63-77.
Katsuki, T.; Martin, V. S. Org. React. 1996, 48, 1-300.
Pfenninger, A. Synthesis 1986, 89-116.
Diidrossilazione
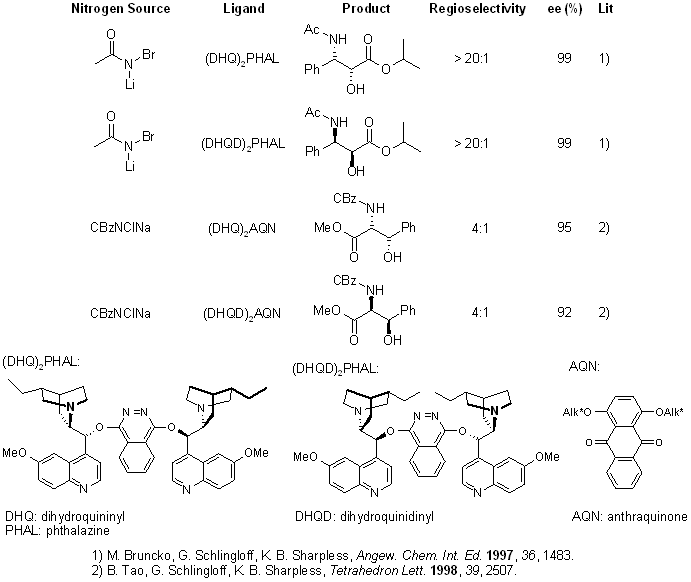
La diidrossilazione o bisidrossilazione di Sharpless è una reazione impiegata nella preparazione enantioselettiva di 1,2-dioli a partire da olefine prochirali. Questa procedura è eseguita con un catalizzatore a base di osmio e con un ossidante stechiometrico [ad esempio K3Fe(CN)3 o N-metilmorfolina ossido (NMO)]; è condotta in una soluzione tamponata per assicurare un pH stabile, dato che la reazione procede più rapidamente in condizione lievemente basiche. L'enantioselettività è ottenuta attraverso l'aggiunta di ligandi chirali enantiomericamente arricchiti [(DHQD)2PHAL, (DHQ)2PHAL o loro derivati]. Questi reagenti sono anche disponibili come miscele stabili, preconfezionate (AD-mix α e AD-mix β, AD = asymmetric dihydroxylation) per entrambe le enatiopreferenze.
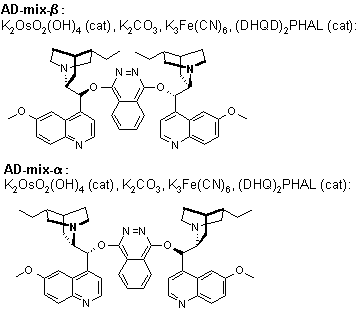
Meccanismo
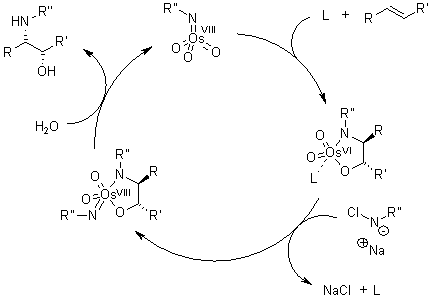
Il ligando accelera la reazione e trasferisce l'informazione chirale.
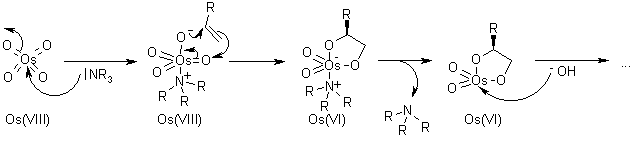
Dopo che il prodotto diidrossilato è rilasciato dal complesso tramite idrolisi, avviene la riossidazione del metallo - in questo esempio è stato impiegato sodio clorito, che può rigenerare due equivalenti del catalizzatore.
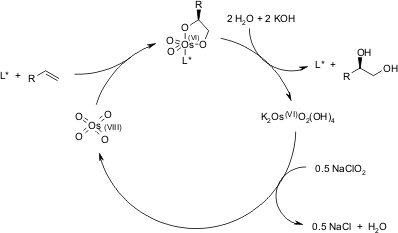
M. H. Junttila, O. E. O. Hormi, J. Org. Chem., 2004, 69, 4816-4820.
Se la concentrazione dell'olefina è troppo elevata, un secondo equivalente del substrato potrebbe legarsi al centro catalitico in assenza del ligando chirale, e subire diidrossilazione. Questa reazione secondaria diminuirà l'enantioselettività.
Ci sono state alcune speculazioni per quanto concerne l'attuale passaggio di addizione, per cui i dati sperimentali suggeriscono il possibile coinvolgimento di due passaggi separati. Quindi, è nata la questione: il passaggio chiave avviene tramite l'iniziale addizione [3+2], o attraverso un'addizione [2+2] seguita da espansione del metallaciclo?
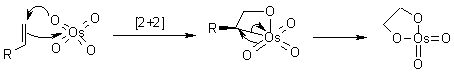
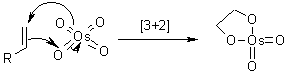
Calcoli quanto meccanici hanno mostrato che un'iniziale addizione [3+2] dell'OsO4 è energeticamente più favorevole. Comunque, questa differenza di energia è sostanzialmente minore di quella delle addizioni correlate di Re(VII) ossido, per esempio. (D. V. Deubel, G. Frenking, Acc. Chem. Res., 2003, 36, 645).
Letteratura recente:

Diidrossilazione asimmetrica catalitica di olefine con il riutilizzabile OsO42- su scambiatori ionici: Scopo e reattività usando diversi co-ossidanti
B. M. Choudary, N. S. Chodari, K. Jyothi, M. L. Kantam, J. Am. Chem. Soc., 2002, 124, 5341-5349.
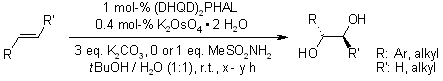
Metansolfonammide: un co-solvente e un catalizzatore acido generale nelle diidrossilazioni asimmetriche di Sharpless
M. H. Junttila, O. O. E. Hormi, J. Org. Chem., 2009, 74, 3038-3047.

Sodio clorito quale efficace ossidante e pompa di ione idrossido nella diidrossilzione asimmetrica catalizzata da osmio
M. H. Junttila, O. E. O. Hormi, J. Org. Chem., 2004, 69, 4816-4820.
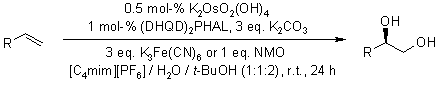
Liquidi ionici quali convenienti nuovi mezzi di reazione per la diidrossilzione asimmetrica catalizzata di olefine usando un complesso osmio/ligando recuperabile e riutilizzabile
L. C. Branco, C. A. M. Afonso, J. Org. Chem., 2004, 69, 4381-4389.
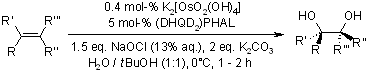
Un nuovo metodo pratico per la diidrossilazione catalizzata da osmio di olefine usando candeggina come ossidante finale
G. M. Mehltretter, S. Bhor, M. Klawonn, C. Döbler, U. Sundermeier, M. Eckert, H.-C. Militzer, M. Beller, Synthesis, 2003, 295-301.
I seguenti utenti ringraziano quimico per questo messaggio: Max Fritz, NaClO3