LuiCap ha scritto:
Un campione di 10 ml di ammoniaca commerciale soluzione acquosa ha richiesto 29,4 ml di HCl 1M per essere neutralizzato. Calcolare il pH e la concentrazione in % p/p dell' ammoniaca acquosa considerando che la sua densità è 1 g/ml
Qui possiamo usare la formula di diluizione per calcolare la concentrazione di ammoniaca.
Non è la formula di diluizione, ma la formula che si usa al punto equivalente di una titolazione fra una base debole (NH3) e un acido forte (HCl), la cui reazione completa è:
NH3 + H+ --> NH4+
n titolante (H+) = 1 mol/L · 0,0294 L = 0,0294 mol
NH3 + H+ --> NH4+
0,0294..0,0294..0
-0,0294..-0,0294..+0,0294
0...........0.............0,0294
n titolato = n titolante
V(NH3) · M(NH3) = V(HCl) · M(HCl)
10 mL · M(NH3) = 29,4 mL · 1 mol/L
M(NH3) = 29,4 mL · 1 mol/L / 10 mL = 2,94 mol/L
Per trasformare la concentrazione della soluzione di NH3 espressa in molarità in % p/p occorrono i seguenti passaggi:
massa soluzione NH3 = 1000 mL · 1 g/mL = 1000 g
massa NH3 = 2,94 mol · 17,03 g/mol = 50,1 g NH3 in 1000 g di soluzione
In 100 g di soluzione:
50,1 g NH3 · 1000 g di soluzione / 100 g di soluzione = 5,01 % p/p
Calcoliamo ora il pH della soluzione di NH3:
NH3 + H2O <--> NH4+ + OH-
2,94....../..............0..........0
-x........../.............+x........+x
2,94-x...................x..........x
Kb = 10^-4,75 = [NH4+][OH-]/[NH3] = x^2 / 2,94-x
Trascurando la x al denominatore si ha:
x = [OH-] = radq (10^-4,75 · 2,94) = 7,23·10^-3 mol/L
pOH = 2,14
pH = 11,86
La reazione tra HCl e soluzione di ammoniaca (NH4OH) è la seguente:
HCl + NH4OH → NH4Cl + H2O
1 mole di HCl è necessaria per neutralizzare 1 mole di NH4OH e produrre 1 mole di NH4Cl.
Il numero di moli di NH4Cl = 0,0294 mol
Il volume totale di NH4Cl = (10 + 29,4) = 39,4 ml = 0,0394 L
La concentrazione di NH4Cl = 0,746 mol /L
Si presume che il valore pKb della soluzione di ammoniaca sia 4,75
Secondo l'equazione di Henderson-Hasselbalch
pOH = pKb + log [NH4Cl] / [NH3]
pKb di ammoniaca è 4,75
pOH = 4,75 + log (0,746) / (2,94)
pOH = 4,75 + log (0,254)
pOH = 4,75 - 0,595
pOH = 4.155
Anche
pOH + pH = 14
4.155 + pH = 14
pH = 9,845
Il valore di pH = 9,845
Ora, la densità della soluzione di ammoniaca = 1 g / ml
Il volume della soluzione di ammoniaca = 10 ml
La massa della soluzione di ammoniaca = Densità ✕ volume = (1 g/ml) ✕ 10 ml = 10 g[
DUBBiO: il testo parla di neutralizzazione, in questo caso NON dovrebbero avanzare moli di NH3 come invece avanzano! se avanzano si forma una soluzione tampone e quindi la formula per il calcolo del pH è giusto, mentre altrimenti dovrebbe essere la formula di l'idrolisi del sale.
Non avanzano assolutamente delle moli di NH3, perché tu stessa hai scritto che
n HCl = n NH3 = 0,0294 mol
LuiCap ha scritto:
Un campione di 10 ml di ammoniaca commerciale soluzione acquosa ha richiesto 29,4 ml di HCl 1M per essere neutralizzato. Calcolare il pH e la concentrazione in % p/p dell' ammoniaca acquosa considerando che la sua densità è 1 g/ml
Qui possiamo usare la formula di diluizione per calcolare la concentrazione di ammoniaca.
Non è la formula di diluizione, ma la formula che si usa al punto equivalente di una titolazione fra una base debole (NH3) e un acido forte (HCl), la cui reazione completa è:
NH3 + H+ --> NH4+
n titolante (H+) = 1 mol/L · 0,0294 L = 0,0294 mol
NH3 + H+ --> NH4+
0,0294..0,0294..0
-0,0294..-0,0294..+0,0294
0...........0.............0,0294
n titolato = n titolante
V(NH3) · M(NH3) = V(HCl) · M(HCl)
10 mL · M(NH3) = 29,4 mL · 1 mol/L
M(NH3) = 29,4 mL · 1 mol/L / 10 mL = 2,94 mol/L
Per trasformare la concentrazione della soluzione di NH3 espressa in molarità in % p/p occorrono i seguenti passaggi:
massa soluzione NH3 = 1000 mL · 1 g/mL = 1000 g
Grazie della risposta, mi sembra tutto corretto, ho solo un dubbio perchè nella massa di soluzione NH3 ha usato 1000 ml e non 10 ml?
massa NH3 = 2,94 mol · 17,03 g/mol = 50,1 g NH3 in 1000 g di soluzione
In 100 g di soluzione:
50,1 g NH3 · 1000 g di soluzione / 100 g di soluzione = 5,01 % p/p
Calcoliamo ora il pH della soluzione di NH3:
NH3 + H2O <--> NH4+ + OH-
2,94....../..............0..........0
-x........../.............+x........+x
2,94-x...................x..........x
Kb = 10^-4,75 = [NH4+][OH-]/[NH3] = x^2 / 2,94-x
Trascurando la x al denominatore si ha:
x = [OH-] = radq (10^-4,75 · 2,94) = 7,23·10^-3 mol/L
pOH = 2,14
pH = 11,86
La reazione tra HCl e soluzione di ammoniaca (NH4OH) è la seguente:
HCl + NH4OH → NH4Cl + H2O
1 mole di HCl è necessaria per neutralizzare 1 mole di NH4OH e produrre 1 mole di NH4Cl.
Il numero di moli di NH4Cl = 0,0294 mol
Il volume totale di NH4Cl = (10 + 29,4) = 39,4 ml = 0,0394 L
La concentrazione di NH4Cl = 0,746 mol /L
Si presume che il valore pKb della soluzione di ammoniaca sia 4,75
Secondo l'equazione di Henderson-Hasselbalch
pOH = pKb + log [NH4Cl] / [NH3]
pKb di ammoniaca è 4,75
pOH = 4,75 + log (0,746) / (2,94)
pOH = 4,75 + log (0,254)
pOH = 4,75 - 0,595
pOH = 4.155
Anche
pOH + pH = 14
4.155 + pH = 14
pH = 9,845
Il valore di pH = 9,845
Ora, la densità della soluzione di ammoniaca = 1 g / ml
Il volume della soluzione di ammoniaca = 10 ml
La massa della soluzione di ammoniaca = Densità ✕ volume = (1 g/ml) ✕ 10 ml = 10 g[
DUBBiO: il testo parla di neutralizzazione, in questo caso NON dovrebbero avanzare moli di NH3 come invece avanzano! se avanzano si forma una soluzione tampone e quindi la formula per il calcolo del pH è giusto, mentre altrimenti dovrebbe essere la formula di l'idrolisi del sale.
Non avanzano assolutamente delle moli di NH3, perché tu stessa hai scritto che
n HCl = n NH3 = 0,0294 mol
ROBERTAGABBIANELLI ha scritto:
Un campione di 10 ml di ammoniaca commerciale soluzione acquosa ha richiesto 29,4 ml di HCl 1M per essere neutralizzato. Calcolare il pH e la concentrazione in % p/p dell' ammoniaca acquosa considerando che la sua densità è 1 g/ml
Qui possiamo usare la formula di diluizione per calcolare la concentrazione di ammoniaca.
Non è la formula di diluizione, ma la formula che si usa al punto equivalente di una titolazione fra una base debole (NH3) e un acido forte (HCl), la cui reazione completa è:
NH3 + H+ 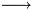 NH4+
NH4+
n titolante (H+) = 1 mol/L · 0,0294 L = 0,0294 mol
NH3 + H+ 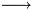 NH4+
NH4+
0,0294..0,0294..0
-0,0294..-0,0294..+0,0294
0...........0.............0,0294
n titolato = n titolante
V(NH3) · M(NH3) = V(HCl) · M(HCl)
10 mL · M(NH3) = 29,4 mL · 1 mol/L
M(NH3) = 29,4 mL · 1 mol/L / 10 mL = 2,94 mol/L
Per trasformare la concentrazione della soluzione di NH3 espressa in molarità in % p/p occorrono i seguenti passaggi:
massa soluzione NH3 = 1000 mL · 1 g/mL = 1000 g
[quote="Citazione:"]
Grazie della risposta, mi sembra tutto corretto, ho solo un dubbio perchè nella massa di soluzione NH3 ha usato 1000 ml e non 10 ml?
massa NH3 = 2,94 mol · 17,03 g/mol = 50,1 g NH3 in 1000 g di soluzione
inolltre credo che per trovare la massa NH3 bisogna fare moli x peso molecolare, quindi 0.0294 x 17.03=0.501 g ...è corretto?
In 100 g di soluzione:
50,1 g NH3 · 1000 g di soluzione / 100 g di soluzione = 5,01 % p/p
Calcoliamo ora il pH della soluzione di NH3:
NH3 + H2O 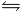 NH4+ + OH-
NH4+ + OH-
2,94....../..............0..........0
-x........../.............+x........+x
2,94-x...................x..........x
Kb = 10^-4,75 = [NH4+][OH-]/[NH3] = x^2 / 2,94-x
Trascurando la x al denominatore si ha:
x = [OH-] = radq (10^-4,75 · 2,94) = 7,23·10^-3 mol/L
pOH = 2,14
pH = 11,86
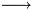 NH4+
NH4+ NH4+ + OH-
NH4+ + OH-