al-ham-bic
2010-05-14 21:34
Premetto che la resa di questa preparazione è stata da schifo (contrariamente al previsto), tuttavia sufficiente a descrivere l'esperienza e farci qualche considerazione, o magari solo per confermare che le sintesi lette sul libro sono sempre perfette...
Materiale occorrente:
- acido borico
- metanolo
- vetreria opportuna
1- Preparazione dell'anidride borica
L'anidride borica B3O3 è facilmente preparabile a partire dall'acido borico H3BO3 per disidratazione a caldo, secondo i seguenti passaggi:
acido borico --> acido metaborico --> acido tetraborico --> anidride borica
H3BO3 --> HBO2 + H2O oltre i 100°
4 HBO2 --> H2B4O7 + H2O oltre i 160°
H2B4O7 --> 2 B2O3 + H2O al calor rosso
Ho agito come segue: porre su una lamina ben pulita di acciaio inox leggermente concava una trentina di grammi di acido borico e scaldare a fiamma diretta con il bunsen; l'acido borico comincia a schiumeggiare, poi fonde e poi si disidrata completamente secondo i passaggi sopra detti. Bisogna insistere molto ed a fiamma forte, al calor rosso, non di meno, fino al cessare del tutto dell'emissione di bollicine di vapore dalla massa fusa. Quando il liquido trasparente di B2O3 è limpido e tranquillo, versarlo ancora rovente su un piano freddo di marmo, dove immediatamente solidifica.
La B2O3 è una massa vetrosa molto dura (sembrano proprio scheggette di vetro), fastidiosissima da polverizzare ma bisogna farlo con l'aiuto di un buon mortaio.
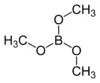
2- Preparazione del trimetilborato
In un pallone da 100 ml munito di condensatore a riflusso porre 40 ml di metanolo e 17,5 g di anidride borica ben polverizzata in piccole porzioni. Dopo l'aggiunta far bollire a riflusso per un'ora. Sostituire l'allhin con un condensatore da distillazione e distillare l'azeotropo metanolo-trimetlborato a una temperatura di 65-70°. Nella raccolta si dovrebbero separare due fasi, la parte superiore consistente in trimetilborato praticamente puro, mentre la più bassa costituita da acqua, metanolo e una piccola quantità di esteri diversi. Il problema che ho incontrato sta in questa fase, anzi proprio "nell'assenza di fasi", poichè ho ottenuto una unica soluzione di trimetilborato in metanolo e non so esattamente in quali proporzioni. Ho notato tuttavia una consistente quantità di B2O3 indecomposta come residuo, indice che la resa è stata molto scarsa, come dicevo all'inizio. Caratteristiche del borato di metile: liquido incolore infiammabile, p.e.68°.
La reazione di sintesi è semplice, la metto direttamente così:
B2O3 + 6 CH3-OH --> 2 (-O-CH3)3B + 3 H2O
Le foto mostrano il caratteristico bellissimo colore verde che il borato di metile impartisce alla fiamma, mettendo in una capsulina una piccola quantità di distillato. La reazione cromatica è molto sensibile e viene anche accendendo direttamente metanolo o etanolo con H3BO3
(un metodo analitico per la ricerca dei borati), ma ovviamente l'intensità dell'effetto è molto maggiore e suggestivo partendo dal prodotto più concentrato, come nel caso delle foto.
I seguenti utenti ringraziano al-ham-bic per questo messaggio: ale93, **R@dIo@TtIvO**, ClaudioG.



 ), in ambiente a bassa T e in THF???
), in ambiente a bassa T e in THF??? chiudo parentesi
chiudo parentesi