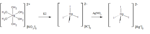Copper-65
2020-05-22 13:43
Buongiorno a tutti!
Oggi vi propongo la sintesi di questo complesso di mercurio, dalla formula Ag2[HgI4], che presenta termocromismo in un range di temperatura facilmente raggiungibile.
Introduzione:
Il fenomeno del termocromismo per questo particolare composto si pensa abbia origine dal trasferimento di carica tra i centri metallici Ag(I) e Hg(II).
E' quindi necessario utilizzare un composto adatto di mercurio(II) oppure eseguire un attacco con un acido ossidante al metallo. Io ho seguito il secondo percorso utilizzando acido nitrico come ossidante che da la seguente reazione nei confronti del mercurio metallico:
3Hg + 8HNO3 --> 3Hg(NO3)2 + 2NO + 4H2O
Il dinitrato di mercurio risulta particolarmente solubile nei mezzi acquosi e passa in soluzione sottoforma di una serie di vari complessi mercurio-nitro che vanno da [Hg(NO3)]+ alla specie tetracordinata [Hg(NO3)4]2-, presente in soluzione ad alta concentrazione di ioni nitrato.
La specie esacquomercurio(II) invece non è praticamente mai presente in soluzione, ma in questa descrizione la assumerò come presente per semplicità dato che non mi è possibile stimare quale dei vari nitrocomplessi è il preominante.
Le reazioni successive che portano alla formazioni del complesso desiderato sono una complessazione con ioni ioduro (soft) che sostituiscono molecole d'acqua e ioni nitrato grazie alla più spiccata polirazzibilità di questi ioni rispetto ai precedenti, questo è dovuto alla maggior affinità del mercurio (II) a questo tipo di agenti complessanti.
Infine si sostituisce il controione, passando da potassio ad argento(I), e causando la precipitazione del prodotto desiderato secondo lo schema successivamente riportato:
Reattivi:
Acido Nitrico al 60% v/v
Argento nitrato
Potassio ioduro
Mercurio metallico
La prima fase consiste nel preparare un apparato che ci permette di evitare, il più possibile, il contatto con soluzioni del metallo e le nebbie che possono essere liberate a seguito di reazioni che liberano gas (principalmente la dissoluzione del mercurio in acido nitrico).
A tale scopo 0,53g di mercurio vengono pesati in una vial per gas cromatografo munita di setto in gomma, questo permette di introdurre i reagenti utilizzando una siringa garantendo un adeguato isolamento del sistema, inoltre viene utilizzato un tubo munito di ago e imbuto che ha la funzione di rilasciare la pressione dal sistema, l'imbuto viene collocato in una soluzione diluita di potassio idrossido che permette lo scrubbing degli ossidi di azoto e, grazie alla geometria dell'imbuto, impedisce il backflow della soluzione nel reattore.
Nell'apparato vengono introdotti 0,54mL di acido nitrico al 60%, considerando un eccesso del 10%, che subito reagisce con il metallo causandone la completa dissoluzione, liberando vari ossidi di azoto.
La soluzione così ottenuta viene da prima diluita con 5mL di acqua distillata e successivamente viene introdotta una soluzione contenente 2g di potassio ioduro, si possono notare due fenomeno.
In primo luogo si ha la formazione di un precipitato di colore rosso-arancio, costituito da HgI2, che dopo l'introduzione del resto della soluzione di ioduro si dissolve nuovamente in soluzione a seguito della formazione del complesso discusso nell'introduzione.
Il secondo fenomeno è l'ossidazione di parte dello ioduro a causa dell'acido nitrico presente in eccesso secondo la seguente equazione:
6I- + 2NO3- + 8H+ --> 3I2 + 2NO + 4H2O
Lo iodio che si forma reagisce rapidamente con l'eccesso di ioni ioduro presenti dando la specie I3- solubile in soluzione acquosa, per questo motivo si è utilizzato un eccesso di potassio ioduro per garantire che tutto il diioduro di mercurio sia passato in soluzione.
Questo problema può essere eliminato utilizzando direttamente un sale di mercurio(II), come il dicloruro di mercurio, oppure rimuovendo l'eccesso di acido nitrico riscaldando la soluzione di nitrato di mercurio.
Tuttavia dato che non sembra nuocere alla sintesi ho deciso di rimuovere uno step di ebollizione dati i rischi derivati da questo processo.
Infine si introduce una soluzione contenente 0,90g di argento nitrato che causa l'immediata precipitazione del complesso desiderato come un solido dal colore giallo accesso che sedimenta velocemente sul fondo del reattore.
A questo punto il prodotto viene filtrato, lavato con acqua e lasciato essiccare fino ad ottenere una polvere che si presenta gialla-ocra a temperatura ambiente, tuttavia quando questa viene potata ad una temperatura superiore ai 50°C si osserva una rapida transizione del colore che diventa rosso-arancione.
Il processo è reversibile e si nota che ponendo il complesso in un freezer (con temperatura di circa -15°C) il complesso assume una colorazione gialla brillante (la descriverei come un giallo evidenziatore).
Per sicurezza consiglierei, a chi intende replicare questo esperimento, di avere a disposizione una soluzione di sodio solfuro per convertire eventuali sversamente di soluzioni di mercurio in solfuro di mercurio, che data la bassissima solubilità risulta meno pericoloso rispetto a composti solubili del metallo.
Infine per lo smaltimento consiglio di seguire la guida del buon Nigel del canale NileRed, dato che spiega egregiamente i dettagli del processo.
Buoni esperimenti a tutti!
Cu-65
I seguenti utenti ringraziano Copper-65 per questo messaggio: thenicktm, FLaCaTa100, ClaudioG., fosgene, luigi_67, zodd01, AndreaChem, ale93, Roberto