Calcolare il pH di una soluzione ottenuta mescolando 28.0 mL di acido nitroso (HNO2) 0.320 mol/L con 22.0 mL di nitrito di potassio (KNO2) 0.410 mol/L sapendo che Ka=4.5*10^-4. Calcolare, inoltre, la variazione di pH in seguito alla aggiunta di 10 mL di una soluzione di NaOH 0.15 mol/L.
Grazie a chiunque vorrà intervenire costruttivamente.
Bozza di soluzione:
n(HNO2) = 0.320*0.028 = 8.96*10^-3 mol
n(KNO2) = 0.410*0.022 = 9.02*10^-3 mol
Vtot = 0.028+0.022 = 0.050 L
[HNO2]= (8.96*10^-3) / (0.050) = 0.1792 mol/L
[KNO2]= (9.02*10^-3) / (0.050) = 0.1804 mol/L
KNO2 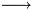 K+ + NO2-
K+ + NO2-
HNO2 + H2O 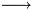 NO2- + H3O+
NO2- + H3O+
[H3O+] = Ka * [HNO2]/[KNO2] = 4.5*10^-4 * (0.1792/0.1804) = 4.47*10^-4
pH = -log[H3O+] = 3.35
Io saprei rispondere costruttivamente se solo tu avessi letto il regolamento 
I seguenti utenti ringraziano LuiCap per questo messaggio: zpp3
Mi scuso e corro a leggere il regolamento. Mi spiace per l'omissione.
Il procedimento e i calcoli sono corretti.
Si tratta di una soluzione tampone nella quale sono presenti contemporaneamente un acido debole (HNO2) e la sua base coniugata (NO2-) nello stesso volume totale di soluzione.
Non è necessario calcolare le molarità della coppia acido-base, poiché il volume totale si annulla:
[H3O+] = 4,5·10^-4 · 8,96·10^-3 / 0,0500 · 0,0500 / 9,02·10^-3 = 4,47·10^-4 mol/L
pH = 3,35
Per una risoluzione più accurata si può anche non trascurare la x come termine sottrattivo ed additivo risolvendo così un'equazione di 2° grado:
x = 4,5·10^-4 · (8,86·10^-3 - x) / (9,02·10^-3 + x) = 4,08·10^-4 mol/L
pH = 3,39
Ricordati che la reazione che determina il pH è un equilibrio, quindi va indicato con la doppia freccia:
HNO2 + H2O <--> NO2- + H3O+
Un suggerimento per la risposta successiva:
n OH- = 0,150 mol/L · 0,0100 L = 1,50·10^-3 mol
HNO2 + OH- --> NO2- + H2O
8,96·10^-3..1,50·10^-3..9,02·10^-3../
-1,50·10^-3..-1,50·10^-3..+1,50·10^-3../
I seguenti utenti ringraziano LuiCap per questo messaggio: zpp3
Infinite grazie, professoressa. Buona giornata e ottima vita! 
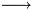 K+ + NO2-
K+ + NO2-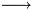 NO2- + H3O+
NO2- + H3O+
