Nell'ambito della ventilata messa in atto di una "competizione" del tipo "proponi la sintesi", sottopongo alla vostra preziosa collaborazione l'obiettivo di sintetizzare
3,4-diidrossifeniletilammina
nome triviale
dopamina
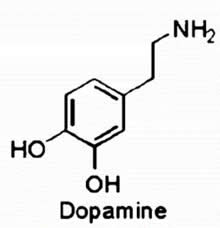
Non c'è nessun premio in paglio. Si tratta del primo di una (potenziale) serie di esercizi, atti a dare libero sfogo alla propria creatività e non di meno conoscienza.
Idealmente, alle proposte attendibili, potrà seguire la sperimentazione (!)
Buon divertimento :esplosivo:
è estremamante complessa una sintesi del genere in laboratorio, nel corpo sono necessari enzimi, amminoacidi tra cui la tirosina etcc.
NaClO3 ma quando mai 
La sintesi è abbastanza semplice! Dipende tutto da dove parti..
sinceramente non saprei, le mie affermazioni si basano su quanto studiato a scuola sulla biosintesi!!
Io parlo della sintesi di laboratorio ovviamente! Non parti da un amminoacido e non ti metti a idrossilare dato che è quasi impossibile da fare 
chiedo scusa.
ma in laboratorio, come agiresti?
Catecolo e il cloruro acilico del monocloroacetico una volta che si attacca il cloroacetico farei una riduzione del CO a CH2 e tratterei con ammoniaca per sostituire il cloro con NH2...
Max Fritz
2010-06-14 11:05
Ma vedete qual è il problema... a questo punto si può partire anche da monocloroacetammide per evitare la reazione finale con NH3... tutto dipende da quali reagenti si hanno a disposizione e di conseguenza che complessità avrà la sintesi.
@ Max: Monocloracetammide, e da ammide a ammina ? In che condizioni ? dove attacca ? quali prodotti in quali proporzioni ? Come purificare ?
@ Chimico: è così semplice ridurre da -COOH a CH3 
Max Fritz
2010-06-22 08:09
@ Nexus: col riarrangiamento di Hofmann... ossiderei con ipobromito a bassa T e in soluzione fortemente basica... dovrebbe dare rese più alte rispetto alla sostituzione del cloro con -NH2... ma non ne sono sicuro.
Son anch'io interessato alla riduzione di -COOH a -CH3, non mi è molto chiara, ma forse "basterebbe" litio alluminio idruro?
Però penso che più indietro dell'alcool sia difficile andare... o sbaglio?
Bromo e fenolo reagiscono già a temperatura ambiente, da cui temo che andresti a bromare l'anello aromatico... dovrei provare in Lab 
Max Fritz
2010-06-22 11:31
Beh, il riarrangiamento di Hofmann è una metodica abbastanza utilizzata ed efficace. Il fenolo non è un'ammide... e poi non consideri l'ambiente basico e la temperatura bassa. Io parlo di far gocciolare lentamente bromo in una soluzione gelata e fortemente basica per NaOH dell'ammide; teoricamente dovrebbe funzionare. In quelle condizioni infatti, non dovrebbe sussistere il problema della bromurazione, poichè il bromo è sequestrato da NaOH prima che possa reagire. Un esempio di utilizzo del riarrangiamento con anello benzoico è la sintesi dell'acido antranilico, che è meglio non approfrondire pubblicamente... ma è comunque testata e abbastanza efficace (non mi pronuncio sulla resa).
Bisognerebbe provare... ho risposto così perchè ho trovato una sintesi del bromofenolo con le stesse condizioni partendo da fenolo, bromo, ambiente basico e basse temperature, benchè classicamente dovrebbe essere presente un bromuro come acido di Lewis perchè si formino bromofenoli...
Max Fritz
2010-06-22 12:12
Ma a quel punto bisogna aggiungercelo il bromuro, dato che a T bassa dovrebbe prevalere la formazione di ipobromito, e non bromuro, mentre a T alta si dovrebbe formare prevalentemente bromato. Dove hai trovato di preciso quella sintesi? Dove avverrebbe la bromurazione?
bromurazione del fenolo
Va in meta e para.
Qui fanno la bromurazione senza bromuro a temperatura ambiente e consigliano di raffreddare in ghiaccio, però qui non parlano di ambiente basico... il link dove parlerebbero di ambiente basico non lo trovo.
Ma l'ambiente basico non dovrebbe aumentare la reattività delle posizioni meta e para ? (risonanza del fenolato)
Max Fritz
2010-06-22 12:51
Non saprei dire, d'altro canto questa risonanza vale anche per il composto in questione o solo per i fenoli? Il riarrangiamento di Hofmann a fenoli non è applicabile... dunque non può avvenire in ogni caso, mentre per le ammidi potrebbe essere favorito alla bromurazione. Lascio la parola ai più esperti 
Nel caso del catecolo penso sarebbero attive tutte le posizioni...
Nexus ha scritto:
@ Chimico: è così semplice ridurre da -COOH a CH3 
è il cloruro dell'acido che attacca...quindi si forma un chetone...che è molto semplice da ridurre in quella posizione...
Mezzo_Prete
2010-06-22 19:01
Benzaldeide + nitrometano.
Mi pare si chiami reazione di Henry.
Una benzaldeide, anche sostituita, condensa con un nitroalcano per dare un intermedio che per riduzione ti porta il nitrogruppo ad ammina.
Con catalisi, chiaramente.
Nel nostro caso ci vuole la 2,4-di-idrossi-benzaldeide.
Vanillina, si idrolizza il metossile.
Dovrebbe essere un legame duro da spaccare.
Sicuramente ci vuole un catalizzatore.
Forse uno tipo PTC (phase transfer catalyst, tipo gli ammoni quaternari).
Il nitrometano è diverso dagli omologhi superiori, voglio dire che si fa in modo diverso.
Max Fritz
2010-06-22 19:32
Dunque, la tua proposta è di partire dalla vanillina, modificare il gruppo -OCH3 in -OH, far reagire l'aldeide con nitrometano, ridurre il gruppo -NO2 ad -NH2 (ferro o zinco + HCl come per la sintesi dell'anilina?) ed è fatta? Come catalizzatore ho letto che si usa preferibilmente cloruro di cetiltrimetilammonio, e la reazione va condotta in sol. basica. L'unico dubbio è che, da quanto ho capito, con la reazione di Henry, il legame C=O dell'aldeide non diventa semplicemente -CH2, ma diventa C-OH, dunque si risolve poco...
Max Fritz
2010-06-22 19:43
Purtroppo però, mi son accorto or ora (e ho corretto il post precedente) che serve anche cloruro di cetiltrimetilammonio... e il problema non è risolto come sembra.
Mezzo_Prete
2010-06-23 10:39
In quanto al C aldeidico che diventa C-OH nella condensazione di Henry, qui:
http://www.chimica.unipd.it/paolo.scrimin/pubblica/CClaisen.pdf
slide 24 trovi il meccanismo.
Alla fine si ottiene C6H5 - CH = CH - NO2
che per riduzione, sicuramente non con Zn - HCl, satura il doppio legame e trasforma il nitro- in amino-gruppo.
Max Fritz
2010-06-23 10:55
Effettivamente da quel link sembra che si formi un doppio legame C=C per trattamento con -OH. Dalla prima reazione appare anche C5H11NH2, che, essendo in formula bruta, non so determinare esattamente cosa sia (pentilammina? e quale isomero?). Inoltre, fa notare la seconda reazione, l'utilizzo di ossido di alluminio: dato che stan venendo fuori nuovi reagenti, prima di stilare il processo completo, sarebbe opportuno trovare una sintesi bell'e fatta di un altro composto che utilizza la reazione di Henry.
Poi: la riduzione del gruppo -NO2 come hai intenzione di effettuarla? Perchè escludi a priori la metodica utilizzata per ridurre C6H5NO2 a C6H5NH2? Mi sembra di intendere che il problema sia la forza del riducente, dato che non deve solo ridurre il gruppo nitro, ma anche il doppio legame C=C.
Max Fritz
2010-10-08 12:22
La discussione è stata riaperta; chiedo però di lasciare da parte l'argomento "nitrometano" (lo si può citare, ma è meglio non parlare della sua reperibilità) 
Se trovassimo un alfa-amminoacido che abbia struttura identica ci arriverei in un passo soltanto. Ci arriverei facilmente anche se dovessi demetilare.
partire dall'eugenolo invece che dalla vanillina non è più semplice?
Sono inciampato in una sintesi della DMPEA (3,4-dimetossifenetilammina), che è una molecola molto simile alla dopamina. Differisce solo perché ha due gruppi metossilici al posto degli ossidrili sull'anello.
Mi chiedo se, con la stessa sintesi, partendo dalla 3,4-diidrossibenzaldeide invece che dalla veratraldeide, si possa ottenere la dopamina...
E' possibile o gli -OH disturbano in qualche modo?
In sostanza per reazione tra aldeide e nitrometano si ottiene un nitrostirene che viene poi ridotto al composto desiderato con litio-alluminio idruro.
Ovviamente è solo una curiosità perché mi mancano troppe cose per farla davvero.
3,4-Dimetossifenetilammina
A solution of 33 g 3,4-dimethoxybenzaldehyde in 140 mL acetic acid was treated with 23 mL nitromethane and 12.5 g anhydrous ammonium acetate, and heated on the steam bath for 45 min. To this there was slowly added, with good stirring, 300 mL H2O, and the resulting solids were removed by filtration. The product was finely ground under a small amount of MeOH, filtered again, and air dried to give 13.5 g 3,4-dimethoxy-beta-nitrostyrene with a mp of 142-143 °C.
To a stirred suspension of 12.0 g LAH in 500 mL anhydrous Et2O that was at a gentle reflux and under an inert atmosphere, there was added 11.45 g 3,4-dimethoxy-beta-nitrostyrene by leaching it from a thimble in a modified Soxhlet condenser. The addition took 2 h and the refluxing was maintained for another 16 h. After cool-ing to room temperature, the excess hydride was destroyed by the cautious addition of 500 mL 1.5 N H2SO4. The phases were separated, and to the aqueous phase there was added 250 g potassium sodium tartrate. The pH was brought to >9, and the clear solution was extracted with 3x100 mL CH2Cl2. Removal of the solvent from the combined extracts under vacuum gave 5.2 g of a pale yellow oil. This was dissolved in 300 mL anhydrous Et2O and saturated with anhydrous HCl gas, giving 5.0 g of a slightly sticky off-white solid. This was recrystallized from 75 mL of boiling CH3CN to give 3.3 g 3,4-dimethoxyphenethylamine hydrochloride (DMPEA) as beautiful white crystals.
Questa sintesi è presa da PIHKAL di A. Shulgin, ma mi sono permesso di postarla comunque, visto che questa molecola non sembra avere nessuna proprietà psicoattiva.
Infatti stavo per dirtelo  ho letto in lungo e in largo i suoi due libri. Sono un chimico di sintesi e impazzisco per le sintesi.
ho letto in lungo e in largo i suoi due libri. Sono un chimico di sintesi e impazzisco per le sintesi.
Di certo non mi metto a farle visti i composti ma mi affascinano assai.
Comunque, penso che alcune sintesi si possano replicare, specie se non conducono a specie psicoattive. Ma non saprei se poi siano legali al 100% o meno... Non vorrei che alcuni siano considerati intermedi per sintesi di altri composti non legali. Ma sono questioni di lana caprina...
Tornando a noi. Gli ossigeni degli OH di norma vengono sempre protetti per impedire che diano luogo a reazioni secondarie, indesiderate. Potrebbe essere che nello step di riduzione con LAH ci siano problemi. E un OMe è sicuramente meno reattivo di un OH libero... Ma non so precisamente in questo caso. O si trova in letteratura qualcosa o si prova a far la sintesi lo stesso 
marco the chemistry
2015-04-16 06:38
Gli -OH aromatici NON si scassano durante la riduzione con LAH...semplicemente il protone è acido e consuma 1 equivalente di idruro... e proteggere un fenolo come metil etere non è mai una buona idea perchè poi non lo togli più....
marco the chemistry ha scritto:
Gli -OH aromatici NON si scassano durante la riduzione con LAH...semplicemente il protone è acido e consuma 1 equivalente di idruro... e proteggere un fenolo come metil etere non è mai una buona idea perchè poi non lo togli più....
Tu quindi dici che riadattando un po' il tutto, questa procedura potrebbe funzionare?
Non intendevo infatti che si scassano ma consumano LAH  infatti è questo che intendevo con reazioni indesiderate, sebbene non sia un termine adatto ma era sera tardi ed ero reduce da 2h di allenamento
infatti è questo che intendevo con reazioni indesiderate, sebbene non sia un termine adatto ma era sera tardi ed ero reduce da 2h di allenamento 
Si consuma un equivalente appunto.
Ok che i metileteri siano scassaminchia e ci vogliano reagenti del menga per toglierli ma se uno ha questa molecola di partenza se la tiene.
Ovviamente se ohilà ha il diidrossi derivato va bene lo stesso, otterrà una molecola diversa da quella riportata.
marco the chemistry
2015-04-16 07:56
Sìsì certo che funziona, ma il nitrostirene lo riduci anche con idrogeno su opportuno catalizzatore. Devo pensare un po' e può andare bene Pd/C o se c'è pericolo di idrogenolisi della posizione benzilica....forse meglio Pd/BaSO4...
Tu che puoi cerca in letteratura... Comunque l'idrogenolisi in casa la vedo dura, se si deve usare idrogeno gassoso.
Potrebbe andare bene formato di ammonio ma penso riduca solo il nitro derivato, e non il doppio legame 
Capisco LAH sia una brutta bestia e non sia adatto per uno che non ha mai fatto questo genere di reazioni ma funziona da dio.
Ficata!  Mi viene quasi voglia di provare a rimediare un po' di nitrometano... Giocando con aldeidi diverse si possono fare parecchi nitrostireni differenti.
Invece la riduzione, almeno a livello pratico, rimane parecchio fuori portata...
Riguardo alle speculazioni teoriche le lascio a voi, che ne capite sicuramente più di me. Però io sto a sentire con interesse.
Mi viene quasi voglia di provare a rimediare un po' di nitrometano... Giocando con aldeidi diverse si possono fare parecchi nitrostireni differenti.
Invece la riduzione, almeno a livello pratico, rimane parecchio fuori portata...
Riguardo alle speculazioni teoriche le lascio a voi, che ne capite sicuramente più di me. Però io sto a sentire con interesse.  Grazie a tutti e due!
Grazie a tutti e due!
I seguenti utenti ringraziano ohilà per questo messaggio: quimico
Beh, diciamo che già farsi nitrostireni potrebbe essere interessante per te, no?
Il dopo si può progettare e rendere magari home-friendly 
quimico ha scritto:
Beh, diciamo che già farsi nitrostireni potrebbe essere interessante per te, no?
Sarebbe molto interessante! 
Poi tutto sommato, una volta trovato il nitrometano, è una cosa fattibile.
Il nitrometano si trova, mi pare si usi come carburante per alcuni modellini di auto e aerei. Non so se sia puro o, come penso, denaturato.
Se no andrebbe comprato dalla SA o da simili. E in quel caso è puro... Ma non so se servano permessi o simili. Al massimo te lo fai comprare da qualcuno 
Dai dai dai. Se lo trovi puoi metterti a provare questa interessante reazione, detta nitroaldolica o reazione di Henry. Ci sarebbe da spendere molto su tale reazione ma sorvoliamo.
Credo sia meglio tenere lontani dal forum i riferimenti a certi chimici non si sa mai. Che quel nome sia nei messaggi del forum già secondo me è un problema.
Sì, ok. Anche io avevo pensato a questa cosa e comprendo... Ma alla fine qui si parla di chimica di sintesi. Non è stata riportata la sintesi pratica.
Si sappia che alcune sostanze sono illegali, nonostante non siano psicoattive, giusto perché intermedi o prodotti in sintesi di derivati che sono psicotropi.
E poi nulla vieta di farsi nitrostireni... Si fanno anche nei laboratori di sintesi in università. E di certo non sono covi di sintesisti alla Walter White.
Sinceramente non saprei che dire se non: state attenti. Sarebbe interessante capirne di più sull'argomento.
I seguenti utenti ringraziano quimico per questo messaggio: ohilà, luigi_67





 ho letto in lungo e in largo i suoi due libri. Sono un chimico di sintesi e impazzisco per le sintesi.
ho letto in lungo e in largo i suoi due libri. Sono un chimico di sintesi e impazzisco per le sintesi. Comunque anche a me era venuto il dubbio che gli ossidrili potessero scassarsi durante la riduzione.
Io non sono riuscito a trovare niente: neanche l'ombra di una sintesi per la dopamina, che non sia la biosintesi... Boh...
In effetti ad avere tutto l'occorrente (cosa non facile!
Comunque anche a me era venuto il dubbio che gli ossidrili potessero scassarsi durante la riduzione.
Io non sono riuscito a trovare niente: neanche l'ombra di una sintesi per la dopamina, che non sia la biosintesi... Boh...
In effetti ad avere tutto l'occorrente (cosa non facile!  infatti è questo che intendevo con reazioni indesiderate, sebbene non sia un termine adatto ma era sera tardi ed ero reduce da 2h di allenamento
infatti è questo che intendevo con reazioni indesiderate, sebbene non sia un termine adatto ma era sera tardi ed ero reduce da 2h di allenamento  Grazie a tutti e due!
Grazie a tutti e due!