Materiali occorrenti
Benzene:tossico:
Acido Nitrico 66%
Acido Solforico 90%
C6H6 + HNO3===> C6H5NO2 + H2O
Lavorare all'aperto o sotto una cappa aspirante.
Prendere un pallone di 500cc mettere 60ml di HNO3 al 66% aggiungere H2SO4 90% 70 ml,lasciare raffreddare,si pesano 50gr di C6H6 aggiungerli apoco alla volta.
Si vedrà una reazione con sviluppo di gas :tossico:e successivamente si sentirà un odore di mandorle amare (essenza di mirbana)raffreddare quando la temperatura aumenta.Aggiunto tutto il benzene si riscalda poi per circa 60 muinuti a 65-70 gradi.
Raffreddata la miscela poi con un imbuto separatore si separa un olio giallo che galleggia sulla miscela nitrante, si sciacqua più volte poi con porzioni di circa 50 ml di acqua,fino a che non sono neutre le acque di lavaggio.Si secca successivamente con cloruro di calcio fuso,poi si distilla il nitrobenzene:tossico: bolle a 207-208°C.
I seguenti utenti ringraziano Kirmer per questo messaggio: Rusty, jobba
ottimo lavoro...ma hai calcolato la resa?
Il volume misurato è di 65 ml.
Devo farne altro perché ho intezione di fare l'anilina.
Complimenti KIrmer, molto interessante la tua sintesi... e ben documentata! Mi chiedevo solamente... il benzene? E' possibile estrarlo in qualche modo dalla comune benzina o da qualche altra sostanza, o devi per forza acquistarlo!?
Grazie,
Ancora complimenti
Saluti 
Rusty ha scritto:
Complimenti KIrmer, molto interessante la tua sintesi... e ben documentata! Mi chiedevo solamente... il benzene? E' possibile estrarlo in qualche modo dalla comune benzina o da qualche altra sostanza, o devi per forza acquistarlo!?
Grazie,
Ancora complimenti
Saluti 
Lo sò che si trova anche nella benzina, per sintetizzarlo non ho trovato nulla su organsys ne su vogel,io l'ho acquistato è cancerogeno l'ho pagato ben € 25/l da microglass ma da un'altra parte non me lo davano meno di 40 euro/l.Lo usavo da ragazzo costava pochissimo e mi divertivo a fare il nitrobenzene e altre cose con l'acetilene,cose altamente pericolose me accorgo adesso.
saluti
Rusty ha scritto:
zampi ha scritto:
io avevo letto che è leggermente cancerogeno  e che lo stanno togiendo anche dalla benzina(hanno in previsione di farlo) sostituendolo con il simile toluene(chi vuole fare la sintesi del tri nitro toluene?
e che lo stanno togiendo anche dalla benzina(hanno in previsione di farlo) sostituendolo con il simile toluene(chi vuole fare la sintesi del tri nitro toluene? 

 ), quindi nella benzina non so se si puo trovarlo....e poi sai quanta altra "cacca" trovi all interno della benzina?
), quindi nella benzina non so se si puo trovarlo....e poi sai quanta altra "cacca" trovi all interno della benzina?
Occhio!!! 

 :esplosivo: :esplosivo: :esplosivo:
:esplosivo: :esplosivo: :esplosivo:
lo so lo so
non invito nessuno a farlo, infatti gli 

 dopo sono mesi li apposta
dopo sono mesi li apposta 
ok sintetizzare, ma il tri nitro toluene non ancora ahahah
thechemicalsistem
2010-01-11 16:47
KIrmer ha scritto:
Si secca successivamente con cloruro di calcio fuso, poi si distilla il nitrobenzene:tossico: bolle a 207-208°C.
come si procede x questa operazione, non ne ho mai sentito parlare 
il benzene si compra.
costa ed è cancerogeno/ mutageno, oltre che tossico. e pericoloso.
ma queste cose penso le sappiate già...
complimenti Kirmer per la sintesi  hai fatto un bel lavoro. come sempre...
l'anilina come la farai? riduzione con Fe/HCl o Sn/HCl?
interessante...
hai fatto un bel lavoro. come sempre...
l'anilina come la farai? riduzione con Fe/HCl o Sn/HCl?
interessante...
Max Fritz
2010-01-11 17:42
Non sarebbe più opportuno usare lo zinco.. se opera per riduzione?
anche Zn/HCl può andare... certo... volevo sapere cosa usava...
quimico ha scritto:
il benzene si compra.
costa ed è cancerogeno/ mutageno, oltre che tossico. e pericoloso.
ma queste cose penso le sappiate già...
complimenti Kirmer per la sintesi  hai fatto un bel lavoro. come sempre...
hai fatto un bel lavoro. come sempre...
l'anilina come la farai? riduzione con Fe/HCl o Sn/HCl?
interessante...
Sì con ferro in polvere e HCl quando la faccio la posterò.
per la purificazione del nitrobenzene si disidrata con CaCl2 anidro e poi si distilla a 207 -209 .
saluti e grazie a tutti
al-ham-bic
2010-01-11 20:45
Ogni sintesi è sempre interessante. Molto bene!
Il nitrobenzene è molto "sensibile" a tracce di umidità, che lo rendono opalescente e non limpido, come si vede in foto. Hai fatto la distillazione, magari scartando la primissima parte? Poi rimane perfettamente trasparente e giallino caratteristico.
---
Nella benzina NON c'è benzene! (Oppure in quantità minima, max 1%, che non si considera e non si può certo ricavare da lì). Un tempo veniva aggiunto per aumentare il numero di ottano, ma quei tempi sono ormai remoti, anche se l'idea errata è rimasta). Il C6H6 si compera e basta.
---
Riguardo i trinitroderivati, detti per scherzo, non è così semplice: già inserire un secondo nitrogruppo presuppone condizioni ben più drastiche, il terzo esponenzialmente di più! Per ora pericolo zero... 
al-ham-bic ha scritto:
Ogni sintesi è sempre interessante. Molto bene!
Il nitrobenzene è molto "sensibile" a tracce di umidità, che lo rendono opalescente e non limpido, come si vede in foto. Hai fatto la distillazione, magari scartando la primissima parte? Poi rimane perfettamente trasparente e giallino caratteristico.
Devo distillarlo ancora ,ma aspetto a farne un'altro pò circa 200cc per ottenere una maggior quantità perché vorrei fare un pò di anilina,e quindi farò una disidratazione con CaCl2 anidro per poi distillarlo e quindi purificarlo.
saluti e grazie
al-ham-bic
2010-01-11 23:29
Ah, ecco, perfetto, ora ci siamo 
Metti poi la sintesi dell'anilina (metodo classico col ferro) e vediamo come va...
Buon lavoro.
ah ochéi... aspetti di averne un bel po' così poi anidrifichi e distilli per aver prodotto puro
ha ragione al-ham-bic nel dire che se metti pure la classica riduzione con Fe/HCl ci faresti un piacere. e altri (al) potrebbero provarla
ma mi chiedevo... l'anilina ottenuta dubito sia incolore vista la facile ossidabilità... che fare? non ricordo se e quale stabilizzante si potrebbe usare
dipende cosa se ne deve fare poi dell'anilina
e ci son tante cose fattibili, reagenti permettendo, da fare
ad esempio un sale di aril diazonio che si potrebbe "quenchare" con ad esempio CuCl/HCl per fare PhCl... oppure CuCN/KCN per fare PhCN
a me piacerebbe provare a fare il PhF con la Balz-Schiemann anche se le condizioni da usare non son poi così friendly...
per la cronaca la reazione di Balz-Schiemann partendo da anilina, PhNH2, può seguire due vie:
- trattamento dell'anilina con HBF4/NaNO2 (a dare HNO2) e successivo trattamento della miscela di reazione con SiO2/Δ o hν, ottenendo così fluorobenzene + N2 + BF3
- trattamento dell'anilina "one-pot" con HF 70%/ piridina, NaNO2
Mi sta fumando la testa con tutte le cose che si possono fare,io ho raccolto un bel pò di reazioni fattibili che ho in programma di fare prima di tutto il P partendo dal metafosfato (lo so che è pericoloso),il cloruro di soforile,cloruro di zolfo ...per utilizzarli in organica per le clorulazioni,dovrei cercare di fare il tricloruro di P(col fosforo rosso)
saluti e grazie
al-ham-bic
2010-01-12 10:29
quimico ha scritto:
...- trattamento dell'anilina con HBF4/NaNO2 (a dare HNO2) e successivo trattamento della miscela di reazione con SiO2/Δ o hν, ottenendo così fluorobenzene + N2 + BF3
Puoi spiegare meglio questa reazione? In che senso con silice, in quali condizioni di T? Ho il sospetto che non sia fattibile nelle modalità come io intendo, ma ci dirai.
Altri reagenti che hai citato (KCN e HF al 70%) non sono disponibili.
L'acido fluoborico (non al 100%) è invece facilmente ottenibile da HF al 40% e H3BO3.
Riguardo una sintesi con l'anilina, presto ne metto una interessante e fattibile senza problemi.
Per Kirmer: il PCl3 purtroppo bisogna comprarlo, come gli altri composti alogenati dello zolfo. La sintesi (operativamente parlando, non in teoria) è troppo impegnativa per ottenerne solo una minima quantità. Quando si lavora in fase eterogenea con i gas (nel caso specifico P4 + Cl2) è sempre una rogna grossa!
KIrmer ha scritto:
Mi sta fumando la testa con tutte le cose che si possono fare,io ho raccolto un bel pò di reazioni fattibili che ho in programma di fare prima di tutto il P partendo dal metafosfato (lo so che è pericoloso),il cloruro di soforile,cloruro di zolfo ...per utilizzarli in organica per le clorulazioni,dovrei cercare di fare il tricloruro di P(col fosforo rosso)
saluti e grazie
Uela complimenti! Bisogna dire che l'ambizione non ti manca se vuoi sintetizzare quella roba! Tra l'altro sono sintesi che interessano molto anche a me, in particolare il PCl[Sub]3[/Sub]
Il problema maggiore naturalmente è la tossicità/volatilità/esplosività delle sostanze che intendi sintetizzare (il CS[Sub]2[/Sub] personalmente mi fa un pò paura per la sua grandissima spanna di concentrazioni con l'aria che possono generare l'esplosione).
Però niente è impossibile, se si ha l'attrezzatura adeguata.
Da parte mia cercherò di aiutarti dove possibile.
Sono incuriosito dalle foto che hai postato per la sintesi del Nitrobenzene... che ne diresti di presentare un pò il tuo laboratorio nell'apposita thread sotto "Attrezzature"? 
Max Fritz
2010-01-12 12:45
... per il PCl3... se hai il fosforo rosso e il bromo fai il PBr3... i bromurati saranno ugualmente interessanti no?
Uela complimenti! Bisogna dire che l'ambizione non ti manca se vuoi sintetizzare quella roba! Tra l'altro sono sintesi che interessano molto anche a me, in particolare il PCl[Sub]3[/Sub]
Il problema maggiore naturalmente è la tossicità/volatilità/esplosività delle sostanze che intendi sintetizzare (il CS[Sub]2[/Sub] personalmente mi fa un pò paura per la sua grandissima spanna di concentrazioni con l'aria che possono generare l'esplosione).
Però niente è impossibile, se si ha l'attrezzatura adeguata.
Da parte mia cercherò di aiutarti dove possibile.
Sono incuriosito dalle foto che hai postato per la sintesi del Nitrobenzene... che ne diresti di presentare un pò il tuo laboratorio nell'apposita thread sotto "Attrezzature"? 
Se guardi bene ci sta il mio laboratorio,prova a vedere sotto il nome KIrmer attrezzature.
io ho indicato il cloruro di zolfo Cl2S2 non il CS2
saluti
KIrmer ha scritto:
Se guardi bene ci sta il mio laboratorio,prova a vedere sotto il nome KIrmer attrezzature.
io ho indicato il cloruro di zolfo Cl2S2 non il CS2
saluti
Sarà meglio che vado a dormire 
Cmq bel lab, tosto! complimenti
al-ham-bic ha scritto:
quimico ha scritto:
...- trattamento dell'anilina con HBF4/NaNO2 (a dare HNO2) e successivo trattamento della miscela di reazione con SiO2/Δ o hν, ottenendo così fluorobenzene + N2 + BF3
Puoi spiegare meglio questa reazione? In che senso con silice, in quali condizioni di T? Ho il sospetto che non sia fattibile nelle modalità come io intendo, ma ci dirai.
spiegarti meglio la reazione in che senso?
meccanismo deazotazione
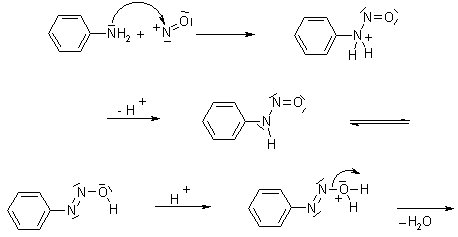
HBF4 e NaNO2 danno come forse ben saprai l'acido HNO2 responsabile della formazione del sale di arildiazonio della anilina ed inoltre si forma NaBF4 che dona uno ione F-
tramite deazotazione si forma il catione Ph+ che non è stabile e reagisce subito con F- a dare PhF
la SiO2 se non ricordo male serve a catturare l'HF che si forma da questa reazione e precipita "SiF4", oltre a formarsi H2O
per quanto riguarda le temperature si usano di norma T = 70°C o 120 °C a seconda del caso in esame
devo guardare in univ qualche articolo?
al-ham-bic
2010-01-12 22:45
OK per la diazotazione, visto che è proprio una delle sintesi che proporrò...
No, pensavo che avessi una procedura ben definita per il C6H5-F e la silice mi lasciava perplesso.
sinceramente non avendola mai fatta tale reazione non so bene le condizioni. andavo a memoria. ma se vuoi ne cerco una che sia fattibile  che cosa proporrai? cioè deazotazione e...?
sarebbe interessante anche magari fare una reazione in cui il sale di arildiazonio quenchi un altro target e dia qualcosa tipo colorante azoico. no?
che cosa proporrai? cioè deazotazione e...?
sarebbe interessante anche magari fare una reazione in cui il sale di arildiazonio quenchi un altro target e dia qualcosa tipo colorante azoico. no?
al-ham-bic
2010-01-12 23:17
Proprio così. Fra un po' la metto.
zampi ha scritto:
...........sostituendolo con il simile toluene.............
Anche il toluene é in eliminazione ( Toluene - Toluolo (Cod. Articolo: 76)- fuori commercio (per tossicità) - proponiamo xilene/xilolo )
Mi sembra che per le clorurazioni si usa di più il PCl[Sub]5[/Sub] che il PCl[Sub]3[/Sub] dico bene ?
Qualcuno può dire qualcosa di più sull'uso di sti cloruranti ? (quando si usa l'uno e quando si usa l'altro)
beh Nexus dipende cosa devi clorurare...
ce ne sono a iosa di reagenti per la clorurazione  il PCl5 tipicamente si usa per clorurare acidi carbossilici... medesimo uso di quando si usa SOCl2 o (COCl)2; inoltre avendo il fosforo in uno stato di ossidazione maggiore è più reattivo
il PCl3 è altresì usato per clorurare acidi carbossilici (anche se viene usato meno rispetto ai sopracitati); ma è più usato per convertire alcoli primari e secondari nei rispettivi cloruri alchilici
è anche usato come disidratante se non ricordo male
il PCl3 inoltre è comodo per la preparazione della trifenilfosfina (o in genere di fosfine) e degli organofosfiti, molto usati nelle olefinazioni (Horner-Wadsworth-Emmons)
il PCl5 tipicamente si usa per clorurare acidi carbossilici... medesimo uso di quando si usa SOCl2 o (COCl)2; inoltre avendo il fosforo in uno stato di ossidazione maggiore è più reattivo
il PCl3 è altresì usato per clorurare acidi carbossilici (anche se viene usato meno rispetto ai sopracitati); ma è più usato per convertire alcoli primari e secondari nei rispettivi cloruri alchilici
è anche usato come disidratante se non ricordo male
il PCl3 inoltre è comodo per la preparazione della trifenilfosfina (o in genere di fosfine) e degli organofosfiti, molto usati nelle olefinazioni (Horner-Wadsworth-Emmons)
I seguenti utenti ringraziano quimico per questo messaggio: Nexus







 il PCl5 tipicamente si usa per clorurare acidi carbossilici... medesimo uso di quando si usa SOCl2 o (COCl)2; inoltre avendo il fosforo in uno stato di ossidazione maggiore è più reattivo
il PCl3 è altresì usato per clorurare acidi carbossilici (anche se viene usato meno rispetto ai sopracitati); ma è più usato per convertire alcoli primari e secondari nei rispettivi cloruri alchilici
è anche usato come disidratante se non ricordo male
il PCl3 inoltre è comodo per la preparazione della trifenilfosfina (o in genere di fosfine) e degli organofosfiti, molto usati nelle olefinazioni (Horner-Wadsworth-Emmons)
il PCl5 tipicamente si usa per clorurare acidi carbossilici... medesimo uso di quando si usa SOCl2 o (COCl)2; inoltre avendo il fosforo in uno stato di ossidazione maggiore è più reattivo
il PCl3 è altresì usato per clorurare acidi carbossilici (anche se viene usato meno rispetto ai sopracitati); ma è più usato per convertire alcoli primari e secondari nei rispettivi cloruri alchilici
è anche usato come disidratante se non ricordo male
il PCl3 inoltre è comodo per la preparazione della trifenilfosfina (o in genere di fosfine) e degli organofosfiti, molto usati nelle olefinazioni (Horner-Wadsworth-Emmons)