 I chimici del Regno Unito hanno sintetizzato il primo nitruro di uranio terminale di uranio, un complesso, al mondo; è stabile a temperatura ambiente. Precedentemente i nitruri di uranio terminali – in cui un atomo singolo di uranio è attaccato ad un singolo atomo di azoto tramite un triplo legame – erano stati visti solo in maniera fugace o isolati con successo ma a temperature di pochi gradi sopra lo zero assoluto. Dubbi sono stati mossi circa il fatto se un legame di tale tipo possa essere davvero stabile.
‘Molte persone pensano che non potrebbe essere possibile fare un nitruro di uranio stabile e se chiedi ad un chimico qualcosa che non può essere fatto questa è una motivazione davvero forte per cercare di farla,’ ha detto Stephen Liddle della University of Nottingham che ha condotto il team di ricerca.
Un nitruro di uranio terminale è difficile da sintetizzare perché l'azoto ha molta voglia di donare la sua carica ad altri atomi di metallo. Il team di Liddle ha costruito dei complessi che consistono di un singolo atomo di uranio incapsulato all'interno di un ligando triammidoaminico polidentato estremamente ingombrato. L'uranio è quasi completamente nascosto, eccetto per una piccola tasca legante in cui un azoto può entrare. Quando la sodio azide (NaN3) è posta a contatto con il complesso, l'uranio un riducente davvero potente prende uno degli azoti e espelle gli altri due. A questo punto l'azoto catturato è infelice e cerca di uscire dalla cavità e si dimena, cercando di catturare un altro metallo nelle vicinanze. Comunque, qualsiasi atomo di uranio vicino è ben coordinato stericamente e fuori dalla portata.
Il secondo punto chiave della strategia del team è stato stabilizzare questi intermedi reattivi. ‘Qui gli ioni sodio dell'azide sono cruciali,’ ha detto Liddle. ‘Questi si attaccano all'azoto, essenzialmente stabilizzandolo e prendendo in mano la situazione.’ Due atomi di sodio formano un ponte tra i due complessi terminali, creando un intermedio meno energetico. Nel passaggio finale del processo gli atomi di sodio sono gradualmente allontanati tramite sequestro con un etere corona, lasciando la coppia ionica cristallina separata, con l'anione contenente la funzionalità nitruro terminale.
‘Dopo molti tentativi di isolare questo legame fugace, la bellezza di questo lavoro è la sua semplicità assoluta,’ ha detto Liddle. ‘Questo lavoro dimostra ancora una volta il ruolo cruciale che i ligandi ancillari giocano nello stabilizzare legami insoliti.’
Commentando lo studio, Jaqueline Kiplinger del Los Alamos National Laboratory negli USA, ha detto: ‘La formazione di un complesso di uranio, un nitruro di uranio, terminale è stato l'ultimo successo nella chimica di sintesi degli attinidi per decenni. Questo è genuinamente un bel capolavoro che aggiunge in modo significativo nuove fondamentali conoscenze della chimica degli elementi del gruppo f. L'isolamento di un nitruro terminale costituisce probabilmente un punto di partenza per ulteriori scoperte in questa area.’
Riferimenti:
DM King et al, Science, 2012, DOI: Science 2012
I chimici del Regno Unito hanno sintetizzato il primo nitruro di uranio terminale di uranio, un complesso, al mondo; è stabile a temperatura ambiente. Precedentemente i nitruri di uranio terminali – in cui un atomo singolo di uranio è attaccato ad un singolo atomo di azoto tramite un triplo legame – erano stati visti solo in maniera fugace o isolati con successo ma a temperature di pochi gradi sopra lo zero assoluto. Dubbi sono stati mossi circa il fatto se un legame di tale tipo possa essere davvero stabile.
‘Molte persone pensano che non potrebbe essere possibile fare un nitruro di uranio stabile e se chiedi ad un chimico qualcosa che non può essere fatto questa è una motivazione davvero forte per cercare di farla,’ ha detto Stephen Liddle della University of Nottingham che ha condotto il team di ricerca.
Un nitruro di uranio terminale è difficile da sintetizzare perché l'azoto ha molta voglia di donare la sua carica ad altri atomi di metallo. Il team di Liddle ha costruito dei complessi che consistono di un singolo atomo di uranio incapsulato all'interno di un ligando triammidoaminico polidentato estremamente ingombrato. L'uranio è quasi completamente nascosto, eccetto per una piccola tasca legante in cui un azoto può entrare. Quando la sodio azide (NaN3) è posta a contatto con il complesso, l'uranio un riducente davvero potente prende uno degli azoti e espelle gli altri due. A questo punto l'azoto catturato è infelice e cerca di uscire dalla cavità e si dimena, cercando di catturare un altro metallo nelle vicinanze. Comunque, qualsiasi atomo di uranio vicino è ben coordinato stericamente e fuori dalla portata.
Il secondo punto chiave della strategia del team è stato stabilizzare questi intermedi reattivi. ‘Qui gli ioni sodio dell'azide sono cruciali,’ ha detto Liddle. ‘Questi si attaccano all'azoto, essenzialmente stabilizzandolo e prendendo in mano la situazione.’ Due atomi di sodio formano un ponte tra i due complessi terminali, creando un intermedio meno energetico. Nel passaggio finale del processo gli atomi di sodio sono gradualmente allontanati tramite sequestro con un etere corona, lasciando la coppia ionica cristallina separata, con l'anione contenente la funzionalità nitruro terminale.
‘Dopo molti tentativi di isolare questo legame fugace, la bellezza di questo lavoro è la sua semplicità assoluta,’ ha detto Liddle. ‘Questo lavoro dimostra ancora una volta il ruolo cruciale che i ligandi ancillari giocano nello stabilizzare legami insoliti.’
Commentando lo studio, Jaqueline Kiplinger del Los Alamos National Laboratory negli USA, ha detto: ‘La formazione di un complesso di uranio, un nitruro di uranio, terminale è stato l'ultimo successo nella chimica di sintesi degli attinidi per decenni. Questo è genuinamente un bel capolavoro che aggiunge in modo significativo nuove fondamentali conoscenze della chimica degli elementi del gruppo f. L'isolamento di un nitruro terminale costituisce probabilmente un punto di partenza per ulteriori scoperte in questa area.’
Riferimenti:
DM King et al, Science, 2012, DOI: Science 2012
I seguenti utenti ringraziano quimico per questo messaggio: rock.angel, jobba, RhOBErThO
Max Fritz
2013-01-11 16:23
Potrebbe essere interessante, su questo argomento, vedere il video a questo link, in cui spiega lo stesso Liddle:
http://www.periodicvideos.com/videos/feature_uranium_nitrogen.htm
I seguenti utenti ringraziano Max Fritz per questo messaggio: rock.angel, quimico, jobba
I complessi di metalli di transizione contenenti legami multipli con ligandi al carbonio, azoto, o ossigeno (L) giocano un ruolo cruciale in una ampia varietà di trasformazioni chimiche e biologiche1.
La chimica dell'elemento uranio U, un attinide, ha certe similitudini con quella del molibdeno e del tungsteno, ed i chimici inorganici hanno visto la possibilitò di espandere la chimica dell'uranio, chimica di legami multipli, ben oltre rispetto a quella del gruppo funzionale uranile, UO22+, da un po' di tempo.
Uno dei più elusivi bersagli è stato un composto di uranio con un gruppo U≡N terminale o "nudo"—un ligando nitruro in cui l'atomo di N non ha interazioni a ponte.
Diversi gruppi di ricerca 2– 7 hanno tentato di isolare una molecola tale ma sono stati ostacolati dall'elevata nucleofilicità ed associata reattività della funzionalità terminale U≡N. King et al. 8 hanno riportato di aver isolato e completamente caratterizzato un complesso di UV alto-valente con un ligando nitruro terminale usando un'elegante procedura di sintesi. King et al. hanno pensato che l'isolamento di una molecola del tipo LnU≡N potrebbe richiedere un ligando eccezionalmente affollato nell'ambiente attorno all'atomo centrale di U, uno che potrebbe precludere i cammini di decomposizione inter- ed intramolecolare.
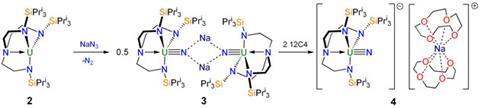
Essi hanno progettato e sintetizzato il ligando trianionico stericamente ingombrante {N(CH2CH2NSiPri3)3}3– o TrenTIPS abbreviato, dove iPr è l'isopropile. Essi isolarono il composto verde di UIV (TrenTIPS)UCl attraverso la reazione a bassa temperatura del Li3TrenTIPS con UCl4 in tetraidrofurano, seguita da ricristallizzazione del prodotto grezzo da toluene.
La riduzione con potassio metallico in esano ha fornito il composto di UIII viola scuro (TrenTIPS)U con rese elevate. La struttura ai raggi X di quest'ultimo ha rivelato una profonda tasca in cui una molecola lineare potrebbe coordinare.
L'ossidazione di quest'ultimo con sodio azide ha eliminato N2 e formato il sale di UV, rosso, dinucleare, pontato tramite atomi di sodio, [[(TrenTIPS)U≡N][Na]]2. La struttura ai raggi X del complesso centrosimmetrico appena ottenuto ha rivelato due gruppi U-N (con una distanza di legame di 1.883 Å) pontati attraverso due cationi Na+ potenzialmente labili.
Il trattamento di questo complesso di UV con 2 equivalenti dell'etere corona chelante, ciclico, 12-corona-4 (12C4) ha incapsulato gli ioni Na+ ed è stato isolato il sale di UV rosso, a ioni separati [(TrenTIPS)U≡N][Na(12C4)2]. Sebbene questo composti si sia dimostrato molto reattivo e si decomponga piuttosto velocemente in solventi eterei formando prodotti intrattabili, esso ha reagito velocemente con trimetilsilil cloruro (Me3SiCl) in toluene formando l'immido complesso rosso, neutro, (TrenTIPS)UNSiMe3, un composto che gli autori hanno preparato indipendentemente trattando (TrenTIPS)U con trimetilsilil azide (Me3SiN3) in toluene.
La struttura cristallina di [(TrenTIPS)U≡N][Na(12C4)2] ha rivelato che la funzione terminale a lunga distanza U≡N con una distanza corta anticipata U-N di 1.825 Å, che è più corta della distanza di 1.916 Å trovata nel nitruro composto di UV con un borano cappato, sintetizzato da Fox e Cummins,
[(C6F5)3BNU(NArBut)3]– (Ar = 3,5-Me2C6H3)9.
Le considerazioni strutturali fatte sui composti [[(TrenTIPS)U≡N][Na]]2 e [(TrenTIPS)U≡N][Na(12C4)2] sono supportate da un gran numero di analisi, tra cui spettroscopia IR ed ottica, marcatura isotopica con 15N, analisi elementale, e liberazione di ammoniaca da [(TrenTIPS)U≡N][Na(12C4)2] tramite trattamento con acqua.
L'assegnamento della valenza UV è anche supportata dai dati di suscettività magnetica dipendenti dalla temperatura.
Sia [[(TrenTIPS)U≡N][Na]]2 che [(TrenTIPS)U≡N][Na(12C4)2] sono silenti all'EPR sotto i 5 K, come ritrovato in alcuni immido complessi trigonali di UV 5,10. Gli autori hanno calcolato le strutture elettroniche del dimero [[(TrenTIPS)U≡N][Na]]2 e dell'anione libero di [(TrenTIPS)U≡N][Na(12C4)2], [(TrenTIPS)U≡N]–, usando la DFT. I parametri metrici calcolati per i due composti sono in buono accordo con i dati strutturali ai raggi X.
L'elettrone singolo dell'U 5f risiede in un HOMO non legante che è essenzialmente puro nel carattere 5f, il che suggerisce che è un bersaglio adatto alla rimozione. Il legame triplo U≡N è un risultato della popolazione dei due orbitali quasi degeneri π e di un orbitale σ, con l'ultimo che è quello a più alta energia. Questo ordine orbitalico è simile a quello del catione uranile11.
Un analisi dell'ordine di legame naturale (NBO) 12 di [(TrenTIPS)U≡N][Na(12C4)2] indica che gli orbitali σ e π associati al legame U≡N sono all'incirca per il 30% U e per il 70% N.
La componente U di entrambi i tipi di legami hanno un apprezzabile carattere orbitalico 5f—43% del legame σ e 72% del legami π.
L'ordine di legame di Mayer U-N è 2.91 per [(TrenTIPS)U≡N][Na(12C4)2], in accordo con la rappresentazione di un legame triplo13. Esso decresce a 2.21 nel [[(TrenTIPS)U≡N][Na]]2, presumibilmente come risultato dell'influenza polarizzante dei cationi Na+. La carica calcolata sull'atomo N del nitruro in [(TrenTIPS)U≡N][Na(12C4)2] è –1.36, che è in accordo con un centro estremamente nucleofilo e la coordinazione stretta dell'Na+ in [[(TrenTIPS)U≡N][Na]]2.
Questi studi sono stati ispirati non solo da un interesse nella chimica fondamentale dell'uranio ma anche dall'interesse della comunità scientifica verso il nitruro di uranio, (UN)x, un attraente combustibile ceramico per i reattori nucleari avanzati14.
Un'ulteriore elaborazione della chimica descritta da King et al. potrebbe prendere diverse direazioni. Per esempio, i complessi [[(TrenTIPS)U≡N][Na]]2 e [(TrenTIPS)U≡N][Na(12C4)2] potrebbero sembrare essere gli ideali materiali di partenza per ulteriori esplorazioni sintetiche della chimica altovalente dell'uranio. Potrebbe essere possibile ossidare il composto [(TrenTIPS)U≡N][Na(12C4)2] ad un composto neutro di UVI (TrenTIPS)U≡N o ridurlo al suo dianione di UIV, [(TrenTIPS)U≡N]2–. Il composto di UIII (TrenTIPS)U è anche un candidato per ulteriori indagini, dato che esso potrebbe reagire con altre piccole molecole come CO, NO, N2O, e CO2.
Riferimenti
1. W. A. Nugent, J. M. Mayer, Metal-Ligand Multiple Bonds (Wiley-Interscience, New York, 1988).
2. A. R. Fox, P. L. Arnold, C. C. Cummins, J. Am. Chem. Soc. 132, 3250 (2010).
3. W. J. Evans, S. A. Kozimor, J. W. Ziller, Science 309, 1835 (2005).
4. I. Korobkov, S. Gambarotta, G. P. A. Yap, Angew. Chem. Int. Ed. 41, 3433 (2002).
5. S. C. Bart et al., J. Am. Chem. Soc. 130, 12536 (2008).
6. R. K. Thomson et al., Nat. Chem. 2, 723 (2010).
7. S. Fortier, G. Wu, T. W. Hayton, J. Am. Chem. Soc. 132, 6888 (2010).
8. D. M. King et al., Science 337, 717 (2012); 10.1126/science.1223488.
9. A. R. Fox, C. C. Cummins, J. Am. Chem. Soc. 131, 5716 (2009).
10. C. R. Graves, J. L. Kipplinger, Chem. Commun. (Camb.) 2009, 3831 (2009).
11. M. Pepper, B. E. Bursten, Chem. Rev. 91, 719 (1991).
12. NBO 5.0., E. D. Glendening et al. (Theoretical Chemistry
Institute, Univ. of Wisconsin, Madison, WI, 2001); www.chem.wisc.edu/~nbo5.
13. A. J. Bridgeman, G. Cavigliasso, L. R. Ireland, J. Rothery,
J. Chem. Soc., Dalton Trans. 2001, 2095 (2001).
14. G. W. C. Silva et al., Inorg. Chem. 48, 10635 (2009).
I seguenti utenti ringraziano quimico per questo messaggio: rock.angel
L'articolo e la notizia sono ormai vecchi ma ho appena visto il video su YT quindi ho deciso di postarvi qualcosa di interessante.
Era da un po' che non postavo qualcosa e sono ispirato. Fuori piove e non sono uscito a bere stasera.
Il titolo in italiano fa cacare lo so... Ma non ero in vena di tradurlo in modo migliore 
Dei ligandi ingombrati creano una piccola tasca in grado di accogliere la prima azide stabile di uranio con un triplo legame al suo interno.
Dei chimici del Regno Unito hanno sintetizzato il primo complesso terminale di azide di uranio che è stabile a temperatura ambiente. In precedenze le azidi terminali di uranio – in cui un singolo atomo di uranio è attaccato ad un singolo atomo di azoto tramite un triplo legame – era stata vista solo fugacamente o anche isolata a temperature alcuni gradi sopra lo zero assoluto. C'erano dubbi sul fatto che un così fatto legame potesse essere stabile.
‘Molte persone pensavano che non potesse essere possibile sintetizzare una azide di uranio stabile e se dicessi ad un chimico di fare qualcosa che non può essere fatto questo potrebbe essere una spinta a provarci,’ ha detto Stephen Liddle della University of Nottingham che ha condotto il team di ricerca.
Una azide di uranio terminale è difficile da costruire perché l'atomo di azoto ha un'enorme voglia di distribuire la sua carica su altri atomi di metalli. Il team di Liddle ha costruito complessi costituiti da una singolo atomo di uranio incapsulati all'interno di ligandi polidentati triammidoaminici estremamente ingombrati. L'atomo di uranio è quasi completamente nascosto, eccezion fatta per una singola piccola tasca che coordina il metallo in cui un atomo di azoto può entrare. Quando la sodio azide (NaN3) è presentata al complesso, l'atomo di uranio fortemente riducente strappa un atomo di azoto e scaccia via gli altri due. A questo punto l'atomo di azoto catturato non è felice e cerca di abbandonare la piccola cavità, cercando di legarsi ad un altro metallo nelle vicinanze. Comunque, qualsiasi atomo di uranio nelle vicinanze è ben impaccato stericamente e fuori portata.
Il secondo passaggio chiave della strategia del team fu quella di stabilizzare questi intermedi reattivi. ‘Qui gli ioni sodio dall'azide sono cruciali,’ ha detto Liddle. ‘Questi si attaccano all'azoto, essenzialmente stabilizzandolo e salvando la situazione.’ Due ioni sodio formano un ponte tra i due complessi azidici terminali, creando un intermedio ad energia minore. Nel passaggio finale del processo gli ioni sodio sono blandamente allontanati sequestrandoli tramite etere corona, lasciando una coppia ionica separata cristallina, con l'anione contenente la funzionalità azidica terminale.
‘Dopo molti tentativi di isolare questo legame elusivo la bellezza di questo lavoro è la sua assoluta semplicità,’ ha detto Liddle. ‘Questo lavoro dimostra ancora una volta il ruolo cruciale che i ligandi ancillari giocano nello stabilizzare insoliti legami.’
Commentando questo studio, Jaqueline Kiplinger dei Los Alamos National Laboratory negli USA, ha detto: ‘La formazione di un complesso terminale azidico di uranio è stato uno degli obiettivi ultimi dei chimici di sintesi che si occupano di attinidi per decadi. Questo è un lavoro genuinamente bello che aggiunge in maniera significativa ulteriore conoscenza sulla fondamentale della chimica degli elementi del blocco f. L'isolamento di un'azide terminale pone la basi per ulteriori scoperte in questa area.’
Riferimenti:
DM King et al, Science, 2012, DOI: 10.1126/science.1223488
http://science.sciencemag.org/content/early/2012/06/27/science.1223488?sid=d794e213-8e60-440f-a6de-f0b251db6902
http://www.nature.com/nchem/journal/v2/n9/abs/nchem.705.html
http://www.lanl.gov/
I seguenti utenti ringraziano quimico per questo messaggio: ohilà, RhOBErThO, NaClO, luigi_67, Claudio
Matteo2000
2017-02-05 10:30
Non aveva già scritto un post sui questo composto? Lungi da me esserne sicuro (non ho ancora conoscenze sufficienti) ma mi sembra lo stesso complesso:
http://www.myttex.net/forum/Thread-Scoperto-il-triplo-legame-Uranio-Azoto
I seguenti utenti ringraziano Matteo2000 per questo messaggio: fosgene, RhOBErThO, NaClO
Immagino cosa fecero i ricercatori dopo la scoperta:da bravi inglesi tutti al pub!
Cavoli. Non ricordavo. Va beh, moderatori o accorpate o cancellate questo.
Scusatemi.
 I chimici del Regno Unito hanno sintetizzato il primo nitruro di uranio terminale di uranio, un complesso, al mondo; è stabile a temperatura ambiente. Precedentemente i nitruri di uranio terminali – in cui un atomo singolo di uranio è attaccato ad un singolo atomo di azoto tramite un triplo legame – erano stati visti solo in maniera fugace o isolati con successo ma a temperature di pochi gradi sopra lo zero assoluto. Dubbi sono stati mossi circa il fatto se un legame di tale tipo possa essere davvero stabile.
‘Molte persone pensano che non potrebbe essere possibile fare un nitruro di uranio stabile e se chiedi ad un chimico qualcosa che non può essere fatto questa è una motivazione davvero forte per cercare di farla,’ ha detto Stephen Liddle della University of Nottingham che ha condotto il team di ricerca.
Un nitruro di uranio terminale è difficile da sintetizzare perché l'azoto ha molta voglia di donare la sua carica ad altri atomi di metallo. Il team di Liddle ha costruito dei complessi che consistono di un singolo atomo di uranio incapsulato all'interno di un ligando triammidoaminico polidentato estremamente ingombrato. L'uranio è quasi completamente nascosto, eccetto per una piccola tasca legante in cui un azoto può entrare. Quando la sodio azide (NaN3) è posta a contatto con il complesso, l'uranio un riducente davvero potente prende uno degli azoti e espelle gli altri due. A questo punto l'azoto catturato è infelice e cerca di uscire dalla cavità e si dimena, cercando di catturare un altro metallo nelle vicinanze. Comunque, qualsiasi atomo di uranio vicino è ben coordinato stericamente e fuori dalla portata.
Il secondo punto chiave della strategia del team è stato stabilizzare questi intermedi reattivi. ‘Qui gli ioni sodio dell'azide sono cruciali,’ ha detto Liddle. ‘Questi si attaccano all'azoto, essenzialmente stabilizzandolo e prendendo in mano la situazione.’ Due atomi di sodio formano un ponte tra i due complessi terminali, creando un intermedio meno energetico. Nel passaggio finale del processo gli atomi di sodio sono gradualmente allontanati tramite sequestro con un etere corona, lasciando la coppia ionica cristallina separata, con l'anione contenente la funzionalità nitruro terminale.
‘Dopo molti tentativi di isolare questo legame fugace, la bellezza di questo lavoro è la sua semplicità assoluta,’ ha detto Liddle. ‘Questo lavoro dimostra ancora una volta il ruolo cruciale che i ligandi ancillari giocano nello stabilizzare legami insoliti.’
Commentando lo studio, Jaqueline Kiplinger del Los Alamos National Laboratory negli USA, ha detto: ‘La formazione di un complesso di uranio, un nitruro di uranio, terminale è stato l'ultimo successo nella chimica di sintesi degli attinidi per decenni. Questo è genuinamente un bel capolavoro che aggiunge in modo significativo nuove fondamentali conoscenze della chimica degli elementi del gruppo f. L'isolamento di un nitruro terminale costituisce probabilmente un punto di partenza per ulteriori scoperte in questa area.’
Riferimenti:
DM King et al, Science, 2012, DOI: Science 2012
I chimici del Regno Unito hanno sintetizzato il primo nitruro di uranio terminale di uranio, un complesso, al mondo; è stabile a temperatura ambiente. Precedentemente i nitruri di uranio terminali – in cui un atomo singolo di uranio è attaccato ad un singolo atomo di azoto tramite un triplo legame – erano stati visti solo in maniera fugace o isolati con successo ma a temperature di pochi gradi sopra lo zero assoluto. Dubbi sono stati mossi circa il fatto se un legame di tale tipo possa essere davvero stabile.
‘Molte persone pensano che non potrebbe essere possibile fare un nitruro di uranio stabile e se chiedi ad un chimico qualcosa che non può essere fatto questa è una motivazione davvero forte per cercare di farla,’ ha detto Stephen Liddle della University of Nottingham che ha condotto il team di ricerca.
Un nitruro di uranio terminale è difficile da sintetizzare perché l'azoto ha molta voglia di donare la sua carica ad altri atomi di metallo. Il team di Liddle ha costruito dei complessi che consistono di un singolo atomo di uranio incapsulato all'interno di un ligando triammidoaminico polidentato estremamente ingombrato. L'uranio è quasi completamente nascosto, eccetto per una piccola tasca legante in cui un azoto può entrare. Quando la sodio azide (NaN3) è posta a contatto con il complesso, l'uranio un riducente davvero potente prende uno degli azoti e espelle gli altri due. A questo punto l'azoto catturato è infelice e cerca di uscire dalla cavità e si dimena, cercando di catturare un altro metallo nelle vicinanze. Comunque, qualsiasi atomo di uranio vicino è ben coordinato stericamente e fuori dalla portata.
Il secondo punto chiave della strategia del team è stato stabilizzare questi intermedi reattivi. ‘Qui gli ioni sodio dell'azide sono cruciali,’ ha detto Liddle. ‘Questi si attaccano all'azoto, essenzialmente stabilizzandolo e prendendo in mano la situazione.’ Due atomi di sodio formano un ponte tra i due complessi terminali, creando un intermedio meno energetico. Nel passaggio finale del processo gli atomi di sodio sono gradualmente allontanati tramite sequestro con un etere corona, lasciando la coppia ionica cristallina separata, con l'anione contenente la funzionalità nitruro terminale.
‘Dopo molti tentativi di isolare questo legame fugace, la bellezza di questo lavoro è la sua semplicità assoluta,’ ha detto Liddle. ‘Questo lavoro dimostra ancora una volta il ruolo cruciale che i ligandi ancillari giocano nello stabilizzare legami insoliti.’
Commentando lo studio, Jaqueline Kiplinger del Los Alamos National Laboratory negli USA, ha detto: ‘La formazione di un complesso di uranio, un nitruro di uranio, terminale è stato l'ultimo successo nella chimica di sintesi degli attinidi per decenni. Questo è genuinamente un bel capolavoro che aggiunge in modo significativo nuove fondamentali conoscenze della chimica degli elementi del gruppo f. L'isolamento di un nitruro terminale costituisce probabilmente un punto di partenza per ulteriori scoperte in questa area.’
Riferimenti:
DM King et al, Science, 2012, DOI: Science 2012
