Martilla
2018-12-21 18:18
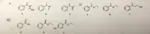
gruppo i) : B - C - A
Ho considerato per le molecole A e C la possibilità di agire da donatori di legami a idrogeno, ciò aumenterebbe le forze aggregative, portando a un incremento della temperatura di ebollizione. La molecola A, dovrebbe essere un sale e ho ipotizzato sia caratterizzate da forze aggregative ancora maggiori rispetto a C.
Gruppo ii) : A- B - C
La temperatura di ebollizione dipende dal PM per cui A dovrebbe avere la temperatura di ebollizione maggiore. In realtà ho considerato sempre la possibilità di instaurare legami a H intermolecolari. -OH funge da donatore( energia maggiore), -O da accettore. Lo zolfo non può formare legami idrogeno, quindi la sua temperatura di fusione è la minore.
Gruppo iii) : A- B -C
La molecola A può dare un legame idrogeno intramolecolare per cui non può dare legami dello stesso tipo con altre molecole e la sua temperatura di ebollizione è la più bassa.
Nella molecola B, l’ossigeno funge da accettore di legame a H, sono presenti delle forze aggregative che aumentano la temperatura di ebollizione.
Nella molecola C non si possono instaurare legami a H intramolecolari, ma solo intermolecolari per OH e O. La temperatura di ebollizione è la più alta.