La memoria è piuttosto labile, specie dopo mezzo secolo che non hai più occasione di rinfrescarla.
Io mi ricordo che quando ero ragazzo e studiavo chimica avevo argentato per deposito galvanico alcuni monili in metallo.
Ora vorrei rifare la stessa operazione, ma non mi ricordo più come avevo fatto, ne se allora avevo fatto un procedimento corretto. 
Mi pare di ricordare che avevo un bagno galvanico con una soluzione di Nitrato di argento (può darsi ?, A che concentrazione ?), poi ad un elettrodo (quale ?) avevo messo una vecchia moneta da 500 Lire di argento che penso servisse per fornire la materia prima ed all'altro elettrodo c'era il mio oggetto da argentare.
Poi, per alcune ore avevo fatto scorrere una corrente (Tensione, amperaggio ?) ed, alla fine, avevo ottenuto il mio oggetto argentato con un discreto spessore e la moneta era invece piuttosto consumata.
Ora, dopo mezzo secolo, l'ho sparata grossa, dicendo a mia moglie che sarei riuscito ad argentare una sua fibbia in metallo, solo che c'è il piccolo particolare, che non mi ricordo più come avevo fatto. 
Potete darmi una mano ?
al-ham-bic
2012-04-18 16:46
Sei proprio sicuro che il risultato fosse venuto bene come ti aspetteresti oggi? 
L'argentatura (come tutte le altre elettrodeposizioni fatte in maniera professionale) non è proprio semplice, dato che si vorrebbe una bella placcatura lucente e stabile, non una porcheria.
Le condizioni del bagno sono determinanti (temperatura, concentrazione, e soprattutto densità di corrente), come il materiale da ricoprire.
Quasi tutti i bagni di argentatura fanno uso di cianuro d'argento.
Eventualmente ti posso postare un paio di pagine del Turco (Hoepli) con delle ricette specifiche.
Ma vediamo se qualcun altro ha da proporre l'uovo di colombo... 
mah io ti avrei detto che basta un soluzione di AgNO3, collegare la fibbia in metallo al catodo, e usare un metallo da ossidare all'anodo, ma leggendo il commento di Al mi sa che non è così banale. posto questo video per darti un metodo alternativo ma non personalmente testato.
http://youtu.be/hUX_cpFWNso
I seguenti utenti ringraziano theiden per questo messaggio: Enotria
Buonasera Enotria,
l'argentatura galvanica solitamente richiede bagni a base di cianuri.
Pur tuttavia esistono anche soluzioni esenti da cianuro, i quali, pur essendo accessibili al dilettante e non particolarmente pericolose da usare, hanno l'inconveniente di dare depositi opachi. Questo per piccole produzioni non è un grosso inconveniente, basta lucidare in seguito.
Solitamente prima di argentare occorre preparare adeguatamente il metallo base. Non conosco di quale materiale sia fatta la fibbia in questione, se di acciaio sarebbe opportuno farla precedere da uno strato sottile di rame in quanto l'aderenza dell'argento al ferro è critica e pone problemi di durata nel tempo. Se di ottone o simili leghe si può (anche se non è il massimo) bypassare questa fase. Ovviamente è indispensabile sgrassare adeguatamente il metallo base (in mancanza di prodotti specifici suggerisco olio di gomito,guanti in gomma e detergenti domestici a base di polveri abrasive tipo Vim Clorex).
Di seguito una formula (le concentrazioni sono in g/L):
Ag.............30
Na2S2O3....250
Na2S2O5....30
pH.............8-10
temperatura: 20-30 °C
densità di corrente: 0,4-1,0 A/dm2
Nota: si parte da argento metallico, lo si scioglie in acido nitrico, si precipita come AgCl, poi lo si scioglie nel tiosolfato e infine si aggiunge il metabisolfito.
saluti
Mario
I seguenti utenti ringraziano Mario per questo messaggio: GabriChan
Vi ringrazio tutti, di sicuro il tempo rende i ricordi più luminosi, più belli.
Evidentemente, come dice al-ham-bic, io a quei tempi mi accontentavo di risultati approssimativi, ed è certamente vero.
Di sicuro non ho utilizzato prodotti a base di cianuro, probabilmente mi sono accontentato di lucidare a forza di Sidol i miei pezzi mal argentati.
Probabilmente erano delle linee accordate in rame, da argentare per migliorare l'effetto Pelle, dato che formavano il sistema risonante di un trasmettitore: allora ero un radioamatore attivo.
Per un profano come me sarebbe molto interessante il metodo suggerito da theiden, sembrerebbe anche troppo semplice, una specie di bagno miracoloso, oltretutto fanno vedere ad argentare un vetro per fare uno specchio ottico e Dio solo sa quanto mi farebbe comodo per riparare i miei microscopi, ma già voi che siete chimici mi pare che abbiate un po' di dubbi che con un po' di soda caustica e di nitrato di argento, il tutto ben zuccherato e ammonizzato, si possa fare il bagno argentatore. 
Pensa un po', l'ultimo prisma che ho fatto argentare da una nota ditta fiorentina mi è costato un centinaio di Euro ed erano 2 cmq scarsi di superficie !
Cordiali saluti
al-ham-bic
2012-04-19 08:03
Enotria ha scritto:
...probabilmente erano delle linee accordate in rame, da argentare per migliorare l'effetto Pelle...
...l'ultimo prisma che ho fatto argentare da una nota ditta fiorentina mi è costato un centinaio di Euro ed erano 2 cmq scarsi di superficie...
A parte tutte le spese accessorie, che saranno state percentualmente rilevanti, ciò la dice lunga sulla "semplicità" di una buona argentatura.
Se proprio vuoi provare (non per gli specchi!) la procedura descritta da Mario mi sembra decisamente quella più valida e perfettamente fattibile (non semplicissima, sia chiaro).
---
Ma quelle linee erano linee di Lecher o magari le bobinette per un buon vecchio converter per le V-UHF? Altri tempi... 
nurd rage in genere é affidabile, l'esperomento in questione non l'ho riprodotto, inoltre credo che lo specchio non sia perfetto però si potrebbe provare
theiden, NurdRage ha riprodotto il saggio di Tollens... è affidabile; ma rimane solo un saggio!
Enotria ha scritto:
Probabilmente erano delle linee accordate in rame, da argentare per migliorare l'effetto Pelle, dato che formavano il sistema risonante di un trasmettitore: allora ero un radioamatore attivo.
Ah però! Allora non sono solo io ad avere questa doppia passione! Per l'argentatura anche io ho assistito a un esperienza del genere (ti parlo dei tempi del primo superiore), ma allora riprodussi in casa solo la "ramatura" e anche nei miei ricordi venne bene. L'argentatura invece ci volevano troppi reagenti chimici che non avevo (e che non ho manco ora).
Se lo fai a titolo di esperienza/curiosità allora fai pure e spendi tutto quello che vuoi! Altrimenti un salto in galvanica, lo fai mettere insieme ad un altro lotto di pezzi ed è molto più semplice!!
Per l'argentatura anche io ho assistito a un esperienza del genere (ti parlo dei tempi del primo superiore), ma allora riprodussi in casa solo la "ramatura" e anche nei miei ricordi venne bene. L'argentatura invece ci volevano troppi reagenti chimici che non avevo (e che non ho manco ora).
Se lo fai a titolo di esperienza/curiosità allora fai pure e spendi tutto quello che vuoi! Altrimenti un salto in galvanica, lo fai mettere insieme ad un altro lotto di pezzi ed è molto più semplice!! Saluti
Saluti
Dott.MorenoZolghetti
2012-04-19 17:47
Perdonate l'ignoranza, ma un immersione del pezzo in argento fuso non andrebbe bene?
anche se ti hanno gia risposto esaurientemente gli altri provo a contribuire anche io:
da quel che so eseguire una argentatura non è facile, o meglio un'argentatura "bella".
quando abbiamo preparato in laboratorio gli elettrodi di argento per argentatura di elettrodi di platino abbiamo aggiunto alla soluzione di AgNO3 cianuro di potassio perchè CN- forma un complesso molto stabile con l'argento che rende la concentrazione degli ioni Ag+ in soluzione molto bassa.
se ricordo bene:
[Ag(CN)2]- <==> Ag+ + 2CN-
Eseguendo l'argentatura l'equilibrio si sposta verso la formazione di nuovi Ag+ e quindi in pratica mantieni il livello di ioni basso e costante, questo viene fatto per ottenere uno strato uniforme senza grumi. Al contrario si si usasse solo nitrato d'argento la concentrazione di Ag+ sarebbe troppo alta e si potrebbero formare grumi.
Tieni conto che questo procedimento è stato svolto per preparare elettrodi da usare in laboratorio quindi non è che ci interessasse molto se venivano belli o meno, quindi ribadisco come hanno detto già altri che fare un bel lavoro non è facile.
C'è anche da tener conto del materiale su cui la esegui perchè bisona considerare se si attacca bene o no e poi ovviamente anche eventuali trattamenti da fare per preservare il lavoro fatto in quanto l'argento se non sbaglio si ossida e quindi si opacizza col tempo (dovrebbere essere lo stesso problema dell'argenteria).
dimenticavo ovviamente KCN :tossico::tossico::tossico: l'ha eseguita il prof sotto cappa....in poche parole non ci giocherei in casa......
Chemistry4888
2012-04-20 20:07
Sfido a trovare qualcuno che possieda KCN (o altro cianuro) a casa (forse il Dott.Zolghetti ed Al potrebbero averli ma non ne sono così sicuro). I cianuri sono diventati difficile da reperire anche per le aziende o per le università con questo non voglio dire che hai fatto male a sottolineare la pericolosità del cianuro anzi, in questi casi mai dare niente per scontato.
Per le università (e per le aziende) sono merce MOLTO rara. Come ho detto anche in altre sedi è assolutamente necessario fare un corso presso la caserma provinciale dei VVdFF, fare un esame, pagare e hai il tuo bell'attestato.
Detto questo trovo ridicolo che vendano il mercurio(II) cianuro, il quale se non erro è forse il più tossico dei cianuri assieme al trimetilsililcianuro, e non quest'ultimo o il sodio cianuro o il potassio cianuro. Son scelte dettate da un motivo (spero).
Cianuri stabili (abbastanza) come il rame(I) cianuro erano venduti fino a pochi anni fa ora non più. Idem per lo zinco(II) cianuro... Ai tempi del mio capo sotto il suo bancone c'era quasi 1kg di questo cianuro (Zn(CN)2)... Non dico sia stata un cosa intelligente ma è per far capire che erano altri tempi. Poi si finisce che si acquistano da strane aziende spesso cinesi... E sono piselli per diabetici.
Non lo trovo giusto. Capisco in mano di una qualsiasi persona che ne abbia accesso possa diventare davvero pericoloso ma non mi pare facciano tutte queste storie per molti altri reagenti decisamente pericolosi  Va beh son solo questioni di lana caprina.
Va beh son solo questioni di lana caprina.
Scusate l'uscita ma ci voleva.
concordo con te. Il punto è che sono pericolosi e in mano a chi non ha competenze possono causare danni irreparabili :tossico: ...........però c'è anche da dire che in questo modo si creano problematiche a chi invece ha le comptenze e magari deve lavorarci.
tornando in argomento non so magari esistono altre sostanze più semplici da reperire e più sicure per fare lo stesso "trucco" che si fa col cianuro, anche se non ho molte speranze perchè da quel che so il cianuro è il metodo che si usa (o almeno si usava) a livello industriale. Forse si sono trovate altre tecniche, non saprei proprio dirti. Dite che un complesso fatto con ammoniaca potrebbe funzionare? se non erro dovrebbe essere [Ag(NH3)2] o qualcosa di simile...
Anche sostanze come il tiofosgene o l'acido perclorico possono diventare pericolosi e causare danni irreparabili ma non mi pare facciano tutto questo fracasso... Boh! Non so che dire.
Quimico, senza andare lontano; lo "sturacessi", vorrei ricordare essere acido solforico a 66°Bè, ovvero al 94-98%p/p.
Chemistry4888
2012-04-20 22:57
Il complesso di Ag(I) con l'ammoniaca è [Ag(NH3)2]+ (con carica positiva) in quanto l'ammoniaca è un legante neutro e non carico negativamente come il cianuro. Tutto dipende dalla costante di formazione del complesso (Kf) che stai utilizzando in quanto da tale valore dipende la concentrazione di ioni argento liberi presenti in soluzione che come hai ben spiegato determina una buona argentatura o meno. In poche parole la concentrazione di ione argento in soluzione non deve essere nè troppo bassa nè troppo abbondante.
Per il complesso [Ag(NH3)2]+ ho trovato la costante di instabilità (Kins) che corrisponde al reciproco della Kf ed è la seguente:
Kinst [Ag(NH3)2]+ = 6,8 * 10-8 --------> Kf [Ag(NH3)2]+ = 1,4 * 10-7
mentre per il complesso [Ag(CN)2]- la sua Kf è la seguente:
Kf [Ag(CN)2]- = 1,0 * 10-21
La Kf di un complesso deriva dalla seguente reazione: M + nL -----> MLn
quindi possiamo esprimere la costante di formazione di un complesso (Kf) secondo questo rapporto: Kf = [MLn]/[M][L]n
Il valore di Kf per il complesso [Ag(CN)2]- è minore rispetto al valore di Kf del complesso [Ag(NH3)2]+ ciò vuol dire che nella soluzione con il complesso [Ag(CN)2]- avrò una concentrazione di ione argento libero (M) maggiore rispetto allo ione argento libero presente nella soluzione contenente il complesso [Ag(NH3)2]+.
In conclusione, credo che utilizzare ammoniaca al posto del cianuro porti alla formazione di un complesso troppo stabile che apporta una concentrazione di ione argento in soluzione troppo bassa per poter effettuare una corretta argentatura.
La soluzione potrebbe essere, provare con un complesso di Ag(I) che abbia una Kf simile a quella del complesso [Ag(CN)2]- ma non possiedo la tabella con le varie Kf dei vari complessi di Ag(I) quindi non posso aiutarti in tal senso.
Dott.MorenoZolghetti
2012-04-20 23:01
Sono tutte supposte effervescenti.
Per un chimico procurarsi cianuro è un giochetto da bambini. Certo, se sei un decerebrato, diventa impegnativo. Il guaio di questa generazione perversa di universitari (esclusi i presenti  ) è che si dividono in due categorie: quelli che vorrebbero fare, ma non sanno fare e quelli che sanno fare e fanno guai. Una via di mezzo ci potrebbe pur essere, ma è impegnata a fare altro.
) è che si dividono in due categorie: quelli che vorrebbero fare, ma non sanno fare e quelli che sanno fare e fanno guai. Una via di mezzo ci potrebbe pur essere, ma è impegnata a fare altro.
Nei laboratori delle università si può fare di tutto, intendo come sintesi, ma il problema resta essere capaci di fare. KCN lo si ottiene purissimo con pochissima fatica. Quello che invece è difficile fare sono le connessioni tra i neuroni.
In effetti il prodotto casalingo per le otturazioni dei sanitari o wc dir si voglia non è una giocattolo, idem il barattolo da 1kg di sodio idrossido che vendono.
Concordo sia facile come detto da Moreno per un chimico procurarsi del cianuro. Io saprei benissimo come fare  avendo le giuste conoscenze ma non mi interessa. Già ora che uso il cianuro di mercurio(II) vado con i piedi di piombo, cerco di lavorare al meglio evitando ogni contatto con esso, e soprattutto evito che gli altri possano essere danneggiati da tale sostanza.
Anche lo smaltimento deve essere fatto con grande e seria attenzione. Ogni oggetto entrato in contatto con tale sostanza deve essere posto in soluzione di NaClO completamente per un paio di ore o più almeno. Il mio camice (uno dei tanti) quando uso i cianuri finisce direttamente in una bacinella colma di candeggina. I guanti prima di finire nel bidone nero dei rifiuti speciali stanno a mollo per almeno un giorno in candeggina. E tutta la vetreria almeno tre giorni. Forse esagero ma la prudenza non è mai troppa.
Io penso, e qui chiudo, che sostanze come queste dovrebbero essere nelle mani di pochi. Forse è troppo o difficili da farsi come cosa ma... Come dice sempre il mio capo non si sa mai cosa possa passare per la testa di una persona. Non dico che altre sostanze non possano arrecare GRAVE danno ma... i cianuri hanno la loro maledetta fama, quest'aura strana attorno.
avendo le giuste conoscenze ma non mi interessa. Già ora che uso il cianuro di mercurio(II) vado con i piedi di piombo, cerco di lavorare al meglio evitando ogni contatto con esso, e soprattutto evito che gli altri possano essere danneggiati da tale sostanza.
Anche lo smaltimento deve essere fatto con grande e seria attenzione. Ogni oggetto entrato in contatto con tale sostanza deve essere posto in soluzione di NaClO completamente per un paio di ore o più almeno. Il mio camice (uno dei tanti) quando uso i cianuri finisce direttamente in una bacinella colma di candeggina. I guanti prima di finire nel bidone nero dei rifiuti speciali stanno a mollo per almeno un giorno in candeggina. E tutta la vetreria almeno tre giorni. Forse esagero ma la prudenza non è mai troppa.
Io penso, e qui chiudo, che sostanze come queste dovrebbero essere nelle mani di pochi. Forse è troppo o difficili da farsi come cosa ma... Come dice sempre il mio capo non si sa mai cosa possa passare per la testa di una persona. Non dico che altre sostanze non possano arrecare GRAVE danno ma... i cianuri hanno la loro maledetta fama, quest'aura strana attorno.
GabriChan
2012-04-21 08:29
Ciao Quimico, forse la cattiva nomea e data dal fatto che ci ammazzano ancora le persone,
http://milano.repubblica.it/cronaca/2012/04/15/news/milano_morto_il_farmacista_che_fu_avvelenato_col_cianuro-33340207/
la cosa interessante è che questo farmacista ha venduto del cianuro per uccidere i ratti,...
e poi lo vendi ad una "amico" che ti deve dei soldi????
Per tornare in tema, un ponte salino, e l'alimentatore messo in modo che eroghi una corrente costante non andrebbe bene?
Credo comunque serva fare qualche test, per avere un risultato ottimale, non credo si riesca ad ottenere un buon risultato al primo tentativo.
Ciao.
Coglione il tizio che ha venduto il cianuro all'amicone  ciò non toglie che poteva anche ucciderlo con della soda o dell'acido solforico...
Torniamo in tema che è meglio.
ciò non toglie che poteva anche ucciderlo con della soda o dell'acido solforico...
Torniamo in tema che è meglio.
Chemistry4888 ha scritto:
Il complesso di Ag(I) con l'ammoniaca è [Ag(NH3)2]+ (con carica positiva) in quanto l'ammoniaca è un legante neutro e non carico negativamente come il cianuro. Tutto dipende dalla costante di formazione del complesso (Kf) che stai utilizzando in quanto da tale valore dipende la concentrazione di ioni argento liberi presenti in soluzione che come hai ben spiegato determina una buona argentatura o meno. In poche parole la concentrazione di ione argento in soluzione non deve essere nè troppo bassa nè troppo abbondante.
Per il complesso [Ag(NH3)2]+ ho trovato la costante di instabilità (Kins) che corrisponde al reciproco della Kf ed è la seguente:
Kinst [Ag(NH3)2]+ = 6,8 * 10-8 --------> Kf [Ag(NH3)2]+ = 1,4 * 10-7
mentre per il complesso [Ag(CN)2]- la sua Kf è la seguente:
Kf [Ag(CN)2]- = 1,0 * 10-21
La Kf di un complesso deriva dalla seguente reazione: M + nL -----> MLn
quindi possiamo esprimere la costante di formazione di un complesso (Kf) secondo questo rapporto: Kf = [MLn]/[M][L]n
Il valore di Kf per il complesso [Ag(CN)2]- è minore rispetto al valore di Kf del complesso [Ag(NH3)2]+ ciò vuol dire che nella soluzione con il complesso [Ag(CN)2]- avrò una concentrazione di ione argento libero (M) maggiore rispetto allo ione argento libero presente nella soluzione contenente il complesso [Ag(NH3)2]+.
In conclusione, credo che utilizzare ammoniaca al posto del cianuro porti alla formazione di un complesso troppo stabile che apporta una concentrazione di ione argento in soluzione troppo bassa per poter effettuare una corretta argentatura.
La soluzione potrebbe essere, provare con un complesso di Ag(I) che abbia una Kf simile a quella del complesso [Ag(CN)2]- ma non possiedo la tabella con le varie Kf dei vari complessi di Ag(I) quindi non posso aiutarti in tal senso.
credo sia l'opposto di quello che hai detto tu, anche se non vorrei sbagliarmi.
la costante di formazione esprimerrebbe la reazione M+nL===>MLn , quindi maggiore è la k di formazione maggiore sarà la quantità di coplesso che si forma.
detto questo la Kf dell' [Ag(CN)2]- è maggiore di quella di [Ag(NH3)2]+ almeno io ho
[Ag(NH3)2]+ Kf=1,6*10^7
[Ag(CN)2]- kf=2,5*10^20
ne deriva che è veramente tanto ma tanto più piccola quindi non va bene con l'ammoniaca c'è troppo Ag+ in soluzione e non legato...
detto questo nella tabella che ho il cianuro risulta essere quello più altro come potere legante, per intenderci il secondo è
Ag+ + 4I- ===> [AgI4]3- kf=1,0*10^14
oppure
Ag+ + 2 (S2O3)2- ===> [Ag(S2O3)2]3- kf=1,7*10^13
ma anche questi sono nettamente molto più bassi, quindi non so se possano funzionare...Detto questo ovviamente esisteranno anche altri complessi rispetto a quelli che ho io in tabella, bisognerebbe trovarne uno con Kf con ordine di grandezza paragonabile a quella del cianuro ovvero compreso fra 10^19 e 10^21.
Potrebbe anche essere che comunque anche con poteri leganti inferiori possano andare bene ma se per fare degli elettrodi in cui l'aspetto estetico di sicuro non è importante si usa il cianuro un motivo ci sarà....detto questo si suppongo che per un chimico esperto non ci voglia molto a procurarselo, io purtroppo sono ancora inesperto quindi non posso aiutarti e comunque non penso sia una buona idea scrivere sul forum come fare...... :tossico: .....anche considerando la storia del farmacista...
al-ham-bic
2012-04-21 09:18
GabriChan ha scritto:
...la cosa interessante è che questo farmacista ha venduto del cianuro per uccidere i ratti,...
Ah,Ah,Ah, questa è buona! (grasse risate di scherno... non mi riferiesco a te Gabri).
Il KCN per uccidere i topi sta in piedi come la mia povera prozia Luigia.
Solo un demente poteva dire una cagata del genere: ===> uno che scrive di chimica sui giornali o che parla al TG.
---
[Spero che tutti i "chimici" presenti siano capaci, almeno in teoria dico, a fare con pochissima fatica quello che dice Zolghetti. Senza riportarlo qui naturalmente (e senza chiedere via mp...  )].
)].
Certo al-ham-bic. Basta poco per qualsiasi cosa. Un po' di cervello.
Non si scherza mai specie con la chimica, specie con queste sostanze.
Anche a me ha fatto "ridere" questa uscita sul KCN e l'uccidere ratti.
Quando troverò un giornalista capace di scrivere un articolo senza cazzate aprirò una bottiglia di vino d'altri tempi...
Credo di aver capito cosa intende Al, in effetti pensandoci 1 minuto ho capito da dove e come (e io NON sono neanche lontanamente un "chimico" molto facilmente (anche troppo facilmente ora che ci penso meglio), è possibile recuperare il sale fatale.
molto facilmente (anche troppo facilmente ora che ci penso meglio), è possibile recuperare il sale fatale.
Non approfondiamo piu' di tanto questo argomento pero', anche perchè stiamo andando un tantino troppo OT verso brutte chine 
Chemistry4888
2012-04-21 14:09
ricky ha scritto:
credo sia l'opposto di quello che hai detto tu, anche se non vorrei sbagliarmi.
la costante di formazione esprimerrebbe la reazione M+nL===>MLn , quindi maggiore è la k di formazione maggiore sarà la quantità di coplesso che si forma.
detto questo la Kf dell' [Ag(CN)2]- è maggiore di quella di [Ag(NH3)2]+ almeno io ho
[Ag(NH3)2]+ Kf=1,6*10^7
[Ag(CN)2]- kf=2,5*10^20
ne deriva che è veramente tanto ma tanto più piccola quindi non va bene con l'ammoniaca c'è troppo Ag+ in soluzione e non legato...
Si si hai ragione, ho copiato male i valori inserendo il segno negativo all'espenente, come hai già ben detto il discorso è inverso a quello da me effettuato, con il complesso dell'ammoniaca c'è troppo ione argento libero rispetto al complesso con il cianuro.
Mi scuso per l'errore 
Per quanto riguarda il farmacista, non dico niente la notizia si commenta da sola. 
ora sarebbe bello sapere se si riesce a trovare una alternativa!  sarebbe una cosa interessante! purtroppo non reisco a trovare niente che si avvicini al valore desiderato...
sarebbe una cosa interessante! purtroppo non reisco a trovare niente che si avvicini al valore desiderato...
Chemistry4888
2012-04-22 01:37
Ho cercato qualche tabella in cui venivano riportate le Kf dei complessi di Ag(I) con vari leganti, purtroppo i migliori che ci sono, oltre a quelli da te citati, ioduro e tiosolfato e naturalmente quello con il cianuro, sono questi:
Kf [Ag(1,10-fenantrolina)2]+ = 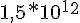
Kf [Ag(SCN)4]3- = 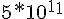
ma siamo sempre nello stesso ordine di grandezza dello ioduro e del tiosolfato. Si potrebbe provare l'argentatura con uno di questi e vedere il risultato finale magari si ottiene comunque una buona argentatura.
sarebbe una cosa interessante si potrebbe tentare con del KI molto in eccesso visti i rapporti stechiometrici sono necessari 4 moli di I- per ogni mole di Ag+
Ma se usi KI non ti si ossida lo iodio all'anodo?
va beh l'importante è che ti si riduca l'Ag+ al catodo! basta mettere tanto tanto iodio in più rispetto all'argento...




 Per l'argentatura anche io ho assistito a un esperienza del genere (ti parlo dei tempi del primo superiore), ma allora riprodussi in casa solo la "ramatura" e anche nei miei ricordi venne bene. L'argentatura invece ci volevano troppi reagenti chimici che non avevo (e che non ho manco ora).
Se lo fai a titolo di esperienza/curiosità allora fai pure e spendi tutto quello che vuoi! Altrimenti un salto in galvanica, lo fai mettere insieme ad un altro lotto di pezzi ed è molto più semplice!!
Per l'argentatura anche io ho assistito a un esperienza del genere (ti parlo dei tempi del primo superiore), ma allora riprodussi in casa solo la "ramatura" e anche nei miei ricordi venne bene. L'argentatura invece ci volevano troppi reagenti chimici che non avevo (e che non ho manco ora).
Se lo fai a titolo di esperienza/curiosità allora fai pure e spendi tutto quello che vuoi! Altrimenti un salto in galvanica, lo fai mettere insieme ad un altro lotto di pezzi ed è molto più semplice!! Va beh son solo questioni di lana caprina.
Va beh son solo questioni di lana caprina. )].
)].

 sarebbe una cosa interessante! purtroppo non reisco a trovare niente che si avvicini al valore desiderato...
sarebbe una cosa interessante! purtroppo non reisco a trovare niente che si avvicini al valore desiderato...