ClaudioG.
2016-08-22 16:15
Buongiorno 
Vedendo la bottiglia di toluene ancora piena nel reagentario mi è venuta voglia di farci una delle reazioni (una delle poche) spiegate al liceo, la nitrazione.
Di seguito la teoria e -nel messaggio successivo a causa del limite degli allegati- la procedura.
Attenzione: i reagenti qui utilizzati sono tossici e/o corrosivi, adottare ogni precauzione per evitare l'esposizione (occhiali, guanti e camice sono obbligatori, così come lavorare in luogo ventilato). Il toluene è inoltre infiammabile, evitare accuratamente fiamme libere, scintille, fonti di calore. Attenzione anche con i prodotti di reazione, tossici e probabili cancerogeni.
Cenni teorici*:
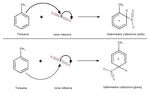
Il toluene (→Toluene), o metilbenzene, è un idrocarburo aromatico, derivato monosostituito del benzene. La sua nitrazione è una sostituzione elettrofila aromatica, reazione importantissima in chimica organica. Essa consiste nella sostituzione di un idrogeno dell'anello benzenico con un elettrofilo, come di seguito:

In questo caso l'elettrofilo è il catione nitrile, o ione nitronio (NO2+), formato dalla reazione tra acido nitrico e solforico. Nel primo stadio di questa reazione un protone viene trasferito dal solforico all'-OH del nitrico, generando un intermedio coniugato e uno ione idrogenosolfato; nel secondo stadio l'intermedio perde una molecola d'acqua, diventando lo ione nitronio, forte elettrofilo (di seguito lo schema: bisogna cliccare sull'immagine sennò non si vede niente):

Essendo il reagente di partenza un benzene monosostituito, occorre fare delle considerazioni sull'effetto del sostituente. La presenza del gruppo metile, infatti, influenzerà sia la posizione del nuovo gruppo, sia la riuscita stessa della disostituzione: il -CH3 è un debole attivante, cioè consente e favorisce -con moderazione- l'entrata di un nuovo gruppo al posto di un idrogeno nell'anello benzenico a cui è legato. Il metile però stabilisce delle condizioni contrattuali per questa condivisione fraterna: direziona infatti il nuovo gruppo in una fra le due sue posizioni preferite nell'anello, quella accanto a sé e quella a lui diametralmente opposta. Quindi è un orto-para orientante.
Significa, in pratica, che la stragrande maggioranza del prodotto sostituito sarà una miscela di isomeri orto e para, e la restante parte una piccola quantità di meta. Nel dettaglio, le percentuali delle quantità dei prodotti di mononitrazione del toluene sono: orto: 58 %, meta: 4 %, para: 38% [Brown]. I prodotti si chiameranno, rispettivamente, orto-mononitrotoluene, meta-mononitrotoluene e para-mononitrotoluene. O, in IUPAC, orto-nitrometilbenzene e via dicendo.
La nitrazione del toluene è 25 volte più rapida di quella del benzene, e bisogna mantenere bassa la temperatura (la miscela tende a scaldarsi abbastanza) per evitare una plurinitrazione (la formazione di dinitrotolueni).
La reazione procede in due stadi.
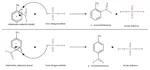
Nel primo stadio -che è quello cineticamente determinante- si ha l'attacco da parte del nitronio (forte elettrofilo) sull'anello benzenico (debole nucleofilo), con formazione di un catione intermedio stabilizzato per risonanza. Di seguito lo schema per gli isomeri orto e para (non ho mostrato la risonanza dell'intermedio, ma fa niente):
Nel secondo stadio lo ione idrogenosolfato si acchiappa l'idrogeno dall'intermedio, neutralizzandone la carica positiva. Si forma il nitrotoluene (para, meta o orto, nelle quantità suddette) e si rigenera acido solforico (che agisce quindi da catalizzatore):
Di seguito le principali caratteristiche chimico-fisiche di o-MNT e di p-MNT, utili successivamente, nella pratica, per riconoscimenti, purificazioni e separazioni:
orto-mononitrotoluene (CAS 88-72-2) ![[Perocoloso per la salute]](images/salute.png.pagespeed.ce.IsqXXoCLKe.png) ,
, ![[Pericoloso per l'ambiente]](images/ambiente.png.pagespeed.ce.MDbzeDsUFv.png)
- Aspetto: in C.N. è un liquido giallino poco viscoso, di un caratteristico odore aromatico (tipo mandorle amare)
- Mm: 137.13 g/mol
- d: 1,16 g/ml
- sol. in H2O (20°C): 0.07%
- P.F.: -10,4 °C
- P.Eb.: 222 °C
- Solubile in etanolo, etere, cloroformio, benzene, ...
para-mononitrotoluene (CAS 99-99-0) ![[Tossico]](images/tossico.png.pagespeed.ce.BU9Uoks0SY.png) ,
, ![[Perocoloso per la salute]](images/salute.png.pagespeed.ce.IsqXXoCLKe.png) ,
, ![[Pericoloso per l'ambiente]](images/ambiente.png.pagespeed.ce.MDbzeDsUFv.png)
- Aspetto: in C.N. sono cristalli giallini, stesso odore dell'isomero orto
- Mm: 137.13 g/mol
- d: 1,10 g/ml
- sol.in H2O (20°C): 0,035 %
- P.F.: 51,7 °C
- P.Eb.: 238 °C
- Solubile in etanolo, etere, benzene, cloroformio, toluene, ...
*Studiati e ripresi da 'Chimica organica' di W.H.Brown, e da varie fonti sul web, tra cui questa.
Segue nel mex successivo. 
 ) che anche di grado tecnico vadano bene.
) che anche di grado tecnico vadano bene.

![[Infiammabile]](images/infiammabile.png.pagespeed.ce.Yw0knUm38k.png) ;
;
![[Corrosivo]](images/corrosivo.png.pagespeed.ce.CTVEf8LXM3.png) ,
, ![[Ossidante]](images/ossidante.png) ,
, 

















 , operando tutti gli accorgimenti del caso!
, operando tutti gli accorgimenti del caso! . In ogni caso fanno bei video, sì
. In ogni caso fanno bei video, sì 