Geber
2021-01-23 13:42
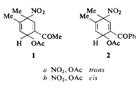
La nitrazione del 3,4-dimetilacetofenone in anidride acetica ha formato una miscela di addotti dienici (68%), un 20% di 3,4-dimetil-6-nitroacetofenone, e piccole quantità degli isomeri 2-nitro e 5-nitro. Gli addotti acetossinitro diastereoisomerici 1a e b sono stati isolati tramite cromatografia. Le rese relative dei prodotti e l'assenza di addotti che risultano dall'attacco alla posizione 4- (ipso) sono coerenti con gli effetti direzionanti combinati dei gruppi acetile e dei due sostituenti metile. I gruppi metile in orto dovrebbero favorire l'attacco elettrofilico nell'ordine posizionale 3 = 4 > 6 > 5 = 2. Il gruppo acetile, che è disattivante, ci si aspetterebbe riduca la reattività della posizione 4-(para) in maniera maggiore rispetto alle posizioni 2- e 6-(orto) e meno di tutte alle posizioni 3- e 5-(meta). L'ordine osservato, 3 > 6 > 5 - 2 > 4, è in accordo con queste aspettative. La nitrazione del 3,4-dimetilacetofenone con miscela di acidi è stata condotta da Buu-Hof et al. che hanno riportato di aver ottenuto il 3,4-dimetil-6-nitroacetofenone, m.p. 120°C, con una resa del 75% assieme al 3,4-dimetil-5-nitroacetofenone. Brandstrom e Carlsson hanno ripetuto questa reazione ed hanno ottenuto una miscela 2:1:1 di 3,4-dimetil-2-nitroacetofenone, m.p. 122°C, 3,4-dimetil-6-nitroacetofenone, m.p. 80°C, e 3,4-dimetil-5-nitroacetofenone. Hanno concluso che Buu Hof et al. hanno identificato in maniera non corretta l'isomero con m.p. 120°C. Gli spettri NMR identificano chiaramente ogni isomero e questo lavoro conferma le osservazioni di Brandstrom e Carlsson che l'isomero con m.p. 120°C è il composto 2-nitro e che l'isomero avente m.p. 80°C è il 3,4-dimetil-6-nitroacetofenone. Comunque, le rese relative dei prodotti di sostituzione che hanno trovato, in cui predomina l'isomero 2-nitro, sono abbastanza diverse dalle rese relative che hanno osservato, dove predomina l'isomero 6-nitro. Si suggerisce che in entrambi i set di condizioni lo ione nitronio è l'elettrofilo attivo e che la sua velocità relativa di attacco alle posizioni nucleari è la medesima. Nelle condizioni estremamente acide relative all'uso di acido solforico (Brandstrom e Carlsson) gli addotti dienici non sono stabili e, se formatisi, rapidamente si convertiranno indietro verso il catione precursore cicloesandienile (5-Ac-2-Me-4) che, tramite shift del gruppo nitro, seguito da perdita del protone, darà i prodotti di sostituzione 2-nitro e 5-nitro del 3,4-dimetilacetofenone. Quindi l'attacco predominante da parte dello ione nitronio alla posizione 3-(ipso) porterà nelle loro condizioni ad un'aumentata resa degli isomeri 2-nitro e 5-nitro. Se il rapporto dell'attacco alle posizioni 2, 3, 5, e 6 che si è osservato, rispettivamente ca. 6, 68, ca. 6, e 20%, rispettivamente, si è assunto essere lo stesso in acido solforico, e se il 68% dell'attacco ipso porta ai derivati 2-nitro e 5-nitro nello stesso rapporto che si è trovato nei riarrangiamenti (3:1) allora le rese osservate dei derivati 2-, 5-, e 6-nitro dovrebbero essere del 57, 23, e 20%, rispettivamente. Ciò è molto vicino al rapporto di 2:1:1 trovato da Brandstrom e Carlsson. Questo fornisce una illustrazione chiara di come l'attacco ipso seguito da riarrangiamento possa complicare l'interpretazione della reattività posizionale determinata dalla distribuzione degli isomeri dei prodotti finali di sostituzione (3, 6, 7). Una soluzione di acido nitrico distillato di fresco (10 cm3, 0.24 mol) in anidride acetica (40cm3) è stata aggiunta al 3,4-dimetilacetofenone (20 g, 0.14 mol) in anidride acetica (60 cm3) a -40°C. La miscela di reazione gialla è stata lasciata a riposo a 2°C durante la notte dopo la quale si è visto che si era formato approssimativamente il 70% di dieni. La miscela è stata lavorata in maniera normale a dare un olio formato dal 68% da dieni, 20% 3,4-dimetil-6-nitroacetophenone, e quantità minori di 3,4-dimetil-2-nitroacetofenone e 3,4-dimetil-5-nitroacetofenone. Cromatografia su allumina -20°C ed eluizione con pentano e miscele etere/pentano danno una miscela di 3,4-dimetilnitroacetofenoni (1.2 g, 6 mmol) nelle frazioni 56-70% etere, trans-2-acetil-4,5-dimetil-4-nitro-1,4-diidrofenil acetato (10.7 g, 42 mmol) nella seconda frazione al 70% in etere, una miscela di isomeri cis e trans (5.4 g, 21 mmol) nella prima frazione 100% etere, e cis-2-acetil-4,5-dimetil-4-nitro-1,4-diidrofenil acetato (1.0 g, 4 mmol) nella seconda frazione 100% etere. La ricristallizzazione dell'isomero trans da cloroformio-pentano ha prodotto cristalli incolori, m.p. 95.5-97°C; UV (CH3OH) 212.5 nm (ε 1130 m2mol-1); IR (Nujol) 1730 e 1245 (OCOCH3), 1680 (COCH3), 1545 e 1380 (NO2), and 930cm-1; NMR. (CDCl3) τ 3.08 (d, 1, 3-H) 3.83 (m, 1, 1-H), 4.00 (m, 1, 6-H), 7.62 (s, 3, COCH3), 7.98 (s, 3, OCOCH3), 8.09 (s, 3, 4-CH3), 8.15 (t, 3, 3-CH,), J1-3 = 0.90, J1-6 = 4.07, J1,5-CH3 = 1.26, J6,5-CH3 = 1.31 HZ.
I seguenti utenti ringraziano Geber per questo messaggio: fosgene, myttex, Fenolo, luigi_67
 ). Quello che penso sia parecchio ostico è la cromatografia su colonna...
). Quello che penso sia parecchio ostico è la cromatografia su colonna...