Mercaptano
2020-09-23 10:44
1. L’idrolisi dei glicosidi di acidi sialici: la famiglia delle Sialidasi.
Le sialidasi, spesso citate come neuraminidasi, sono enzimi del tipo glicoside idrolasi, noti anche come glicosidasi, (Enzyme Commission Number 3.2.1, abbreviato in E.C. 3.2.1) che in generale catalizzano l’idrolisi di legami O- ed N- glicosidici in substrati più o meno complessi.
Nello specifico, le sialidasi catalizzano la rottura del legame glicosidico tra residui di acidi sialici e altri monosaccaridi o tra diverse molecole di acidi sialici all’interno di acidi oligo- e poli-sialici.
Si tratta dunque di proteine ad azione catalitica, espresse per lo più sulla superficie di patogeni procariotici e virali (si veda l’NA dei sopracitati virus influenzali) ma che sono state isolate e studiate anche in cellule di mammifero (sottotipi da NEU1 a NEU4 nell’uomo).
Anche se agiscono tutte su legami di tipo α-glicosidico, esistono sialidasi di diversa natura, in base alla posizione del legame di cui catalizzano l’idrolisi all’interno della catena polimerica.
I legami glicosidici presenti in natura tra residui sialosidici e altri monosaccaridi possono essere idrolizzati sia a livello delle estremità non riducenti terminali, sia, negli acidi polisialici, a livello di un legame glicosidico casuale all’interno del substrato (non necessariamente terminale).
Nello specifico, in base a queste caratteristiche, si distingue rispettivamente tra eso-α sialidasi (E.C. 3.2.1.18) ed endo-α-sialidasi (E.C. 3.2.1.129).
Le endo-α-sialidasi, a volte riportate erroneamente come endo-N-acetylneuraminidasi, operano in maniera casuale sui legami α 2 --> 8 all’interno di catene di acidi oligo- e poli-sialici. In questa trattazione, avendo rilievo marginale, non verranno ulteriormente approfondite.
Le eso-α-sialidasi, invece, sono in grado di catalizzare solo l’idrolisi dei legami α 2 --> 3 o α 2 --> 6 e α 2 --> 8 glicosidici dei residui terminali di Neu5Ac (e di altri acidi sialici, in base al substrato impiegato).
Con particolare riferimento alle sialidasi influenzali, ovvero alle glicoproteine di superficie neuraminidasi (NA) di Influenza Virus A e B, si può fare una accurata analisi di quali siano le strutture e i siti di cui si compongono, le zone del virione in cui sono espresse e il meccanismo di catalisi (per quest'ultimo VEDI DISCUSSIONE "Una chiacchierata su: Neuraminidasi e loro meccanismo enzimatico").
2. Localizzazione dell’enzima.
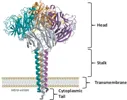
Innanzitutto, si può partire dalla localizzazione di questi enzimi nella architettura virale. Si tratta infatti di proteine di superficie, il cui dominio catalitico è esposto all’esterno del pericapside.
Per molti aspetti vi sono analogie tra le proteine di superficie virali e cellulari, in quanto le prime condividono quasi sempre la struttura fosfolipidica su cui sono espresse con le seconde (si ricorda a tal proposito che le membrane citoplasmatiche e dell’apparato di Golgi sono le strutture cellulari che danno origine agli envelope, o pericapsidi, per passaggio del virione nudo attraverso la struttura a doppio strato fosfolipidico).
3. Struttura delle eso-α-sialidasi virali
Le neuraminidasi virali hanno un peso molecolare di circa 240 kDa e posseggono un totale di 4 domini distinti.
In particolare: ancorato alla membrana si trova un dominio detto “coda citoplasmatica” (cytoplasmatic tail), che si lega alla struttura lipidica della porzione interna del pericapside. Tale struttura, prosegue nella “regione transmembrana” (transmembrane region), che come suggerisce il termine, corrisponde al dominio che attraversa da parte a parte il mosaico fluido dei fosfolipidi.
A questa struttura, si lega la prima porzione dell’ectodominio, dalla tipica forma di uno stelo allungato (stalk), che si protende verso l’esterno e culmina nelle quattro subunità del dominio catalitico (catalytic head).
Il dominio catalitico appena citato è formato da un omotetramero di 4 subunità identiche, che si associano al gambo in una tipica struttura fungiforme.
Sulla superficie di queste quattro subunità, sono localizzati i siti attivi (solitamente uno per catena polipeptidica). Si tratta di larghe cavità che ospitano i residui amminoacidici a funzione catalitica dell’enzima e sono presenti in maniera simile all’interno di tutti i sottotipi delle sialidasi correlate alla patogenesi dell’influenza.
Ogni subunità dell’ectodominio è composta da sei β-foglietti (ognuno formato da 4 β-filamenti antiparalleli) organizzati in strutture che ricordano le pale di un’elica. La struttura tridimensionale del monomero che ne deriva è determinata anche da ponti disolfuro in numero variabile, che agiscono stabilizzando e connettendo tra loro le strutture dei β-foglietti.
Il prodotto della reazione di idrolisi, il Neu5Ac, può essere isolato in un complesso enzima-prodotto all’interno del sito attivo, ma in condizioni normali se ne distacca, liberando il prodotto, e permettendo così l’inizio di una nuova reazione.
Il sito attivo precedentemente citato è posto sulla superficie esterna laterale delle subunità, e presenta un grande (e inusuale) numero di residui amminoacidici carichi. I residui che interagiscono direttamente con Neu5Ac sono conservati senza variazioni in quasi tutti i sottotipi di NA virale, spesso anche in caso di antigenic drift.
In natura l’attività dell’enzima avviene esclusivamente quando il dominio catalitico è presente in forma di omotetramero, seppure sia stata osservata attività catalitica delle singole subunità in forme mutanti dell’enzima,
Nel corso delle ricerche per comprendere il meccanismo di catalisi, si è scoperta la presenza all’interno di questi enzimi di ioni calcio come cofattori.
È possibile trovare tali cationi complessati in posizioni di legame diverse.
Nella prima posizione, si può trovare il Ca2+ coordinato da svariati residui amminoacidici, posti vicino al sito attivo in ogni subunità.
Una seconda posizione di legame per lo ione Ca2+ è presente all’intersezione tra gli assi di simmetria che individuano le quattro subunità dell’ectodominio.
Il ruolo dello ione calcio nella attività enzimatica non è tuttora ben chiaro, ma l’ipotesi più probabile è che abbia implicazioni nella regolazione allosterica dell’enzima, modulandone positivamente l’attività. Secondo altre ipotesi, potrebbe contribuire a rendere termostabile la struttura proteica e promuovere il mantenimento dell’attività del sito attivo, ricco di residui amminoacidici carichi.
Rappresentazione della struttura dell’enzima, con evidenziati i 4 domini catalitici.
4
. I substrati delle sialidasi: derivati dell’acido neuraminicoPer poter parlare in maniera esaustiva della terapia farmacologica di influenza A e B, causate entrambe da degli Orthomyxovirdae, bisogna comprendere innanzitutto come avvengono il processo di adsorbimento e il rilascio dei virioni a ciclo virale compiuto. Quest’ultima fase del ciclo di replicazione, cruciale perché i virus replicati possano infettare altri ospiti, è mediata dall’enzima neuraminidasi, che presenta un substrato molto particolare: i derivati dell’acido-N-acetilneuraminico (N-Acetyl-Neuraminic-Acid, abbreviato in NANA, Figura 2) in posizione terminale rispetto alle catene di oligo- e polisaccaridi legati alle proteine di membrana delle cellule ospiti.
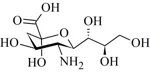
Acido neuraminico
Il NANA, più in genere, è il principale esponente di una famiglia piuttosto vasta di monosaccaridi, gli acidi sialici.
Nella terminologia comune, è ricorrente l’utilizzo del nome acido sialico per riferirsi espressamente al NANA ma, nella realtà, la famiglia di questi amminozuccheri è più complessa.
Strutturalmente, possiamo riassumerla come l’insieme di tutti i derivati N- ed O- sostituiti dell’acido α-neuraminico (Neu), un derivato carbossilico di amminozucchero che presenta la struttura disegnata nella figura seguente (la numerazione, non esplicitata, parte dal gruppo carbossilico).
Acido N-acetil-neuraminico (NANA)
Essendo un derivato del Neu, il NANA è spesso riportato come Neu5Ac, per indicare come sia N-acetilato (evidenziato in blu nella Figura sopra) in posizione 5. A pH fisiologico umano (≈ 7,4 ±0,5), Neu5Ac è carico negativamente, in quanto il gruppo carbossilico è deprotonato.
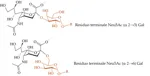
L’acido sialico più ricorrente nei mammiferi, e quindi anche nell’uomo, è proprio Neu5Ac, presente alle estremità di proteine o lipidi glicosilati secondo le strutture in Figura 3, dove R è il proseguire di una catena oligo- o polisaccaridica che si lega ad una proteina di membrana o a un lipide. È facile notare come il legame glicosidico in cui Neu5Ac è coinvolto possa risultare diverso da cellula ospite a cellula ospite. Vi possono essere infatti NANA che si legano ad altri monomeri mediante formazione di un legame acetalico (glicosidico) α 2 --> 6 e altri che lo fanno mediante legame α 2 --> 3 (in riferimento ai recettori espressi negli epiteli delle vie respiratorie).
È più raro trovare residui terminali di Neu5Ac coinvolti in legami α 2 --> 8, cosa invece piuttosto comune negli acidi oligo- e poli-sialici.
I virus influenzali A e B, si adsorbono al NANA mediante la glicoproteina HA (emoagglutinina), formando un complesso proteina-ligando molto stabile, il quale agevola successivamente la fusione del pericapside alla membrana.
Per poter portare a termine il ciclo di replicazione virale, vi è però la necessità che le estremità di NANA dei polisaccaridi espressi sulla membrana citoplasmatica (a cui altrimenti si legherebbe l’HA dei virioni in uscita), vengano idrolizzate per via enzimatica da una sialidasi, per permettere così il rilascio dei virus replicati.
Differenti tipologie di legame glicosidico tra Neu5Ac terminale e galattosio.
Entrambe le strutture sono espresse negli epiteli delle vie respiratorie, ma in zone tissutali diverse.
I seguenti utenti ringraziano Mercaptano per questo messaggio: luigi_67