Rosa
2018-08-02 21:34
Buonasera stavo provando a leggere questo grafico nell'allegato 3 ma non capisco perché la kps' , la ka' e la kw' sono moltiplicate per 10^10, 10^5, 10^14. Perché?
Rosa
2018-08-02 21:34
Buonasera stavo provando a leggere questo grafico nell'allegato 3 ma non capisco perché la kps' , la ka' e la kw' sono moltiplicate per 10^10, 10^5, 10^14. Perché?
LuiCap
2018-08-03 12:26
Hai deciso di passare le tue vacanze interpretando grafici??? 
Il grafico mostra come variano le curve:
A) Kw dell'H2O
B) Ks del BaSO4(s)
C) Ka del CH3COOH
in presenza di un elettrolita forte (NaCl) a varie concentrazioni molari, cioè al variare della forza ionica della soluzione.
La scala in ordinata è, per ciascuna curva:
A) [H+][OH-]
B) [Ba2+][SO4(2-)]
C) [CH3COO-][H+]/[CH3COOH]
ed è espresso senza la relativa potenza del 10, quindi ogni valore numerico è moltiplicato per ciascuna curva:
A) x 10^14
B) x 10^10
C) x 10^5
Prova tu a commentare le altre curve.
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-03 12:45
Grazie mille ci proverò!
Ot:  eh infatti pensavo di far vacanza dopo gli esami, ma poi visto che me ne è rimasto solo 1(Chimica analitica) ci ho ripensato, in realtà purtroppo per Lei credo di avere una dipendenza da questa condizione di studente-prepara esami (le vacanze e l'ozio dopo un po' di giorni annoiano ancor di più
eh infatti pensavo di far vacanza dopo gli esami, ma poi visto che me ne è rimasto solo 1(Chimica analitica) ci ho ripensato, in realtà purtroppo per Lei credo di avere una dipendenza da questa condizione di studente-prepara esami (le vacanze e l'ozio dopo un po' di giorni annoiano ancor di più  ) ...vorrei davvero ricambiarLa
) ...vorrei davvero ricambiarLa
Rosa
2018-08-03 14:59
Intanto che cercavo di commentare la curva B mi è sorto un dubbio: perché Lei ha messo come ordinata del punto a y=1×10^14 e non 1×10^-14? Non sarebbero le coordinate (10^-6.5; 10^-14)?
Grazie!

Rosa
2018-08-03 16:50
Ho proseguito con l'altra curva C ma non mi convince la roba che ho scritto!
LuiCap
2018-08-03 16:59
Prima di capire come è suddivisa la scala in ordinate del grafico, bisogna che tu abbia chiaro il concetto di costante di equilibrio.
Le costanti di equilibrio termodinamiche sono il rapporto tra le attività dei prodotti elevate al loro coefficiente stechiometrico e le attività dei reagenti elevate al loro coefficiente stechiometrico.
In soluzione acquosa le attività dei solidi e dei liquidi puri è sempre uguale a 1.
Perciò:
Kw = a(H+) · a(OH-) = 1,0·10^-14
Ks = a(Ba2+) · a(SO42-) = 1,1·10^-10
Ka = a(CH3COO-) · a(H+) / a(CH3COOH)
L'attività è una grandezza adimensionale, perciò anche la costante di equilibrio non ha dimensioni.
L'attività coincide con la concentrazione solo quando il coefficiente di attività è unitario:
a = f · C
Il coefficiente di attività è unitario quando la forza ionica della soluzione è nulla.
Se la forza ionica della soluzione non è nulla, la costante di equilibrio in concentrazione, cioè il rapporto tra le concentrazioni dei prodotti elevate al loro coefficiente stechiometrico e le concentrazioni dei reagenti elevate al loro coefficiente stechiometrico, è sempre maggiore della costante di equilibrio in attività.
Questo concetto è rappresentato dal grafico in questione, infatti:
A) K'w > Kw ossia 1,7·10^-14 > 1,0·10^-14
B) K's > Ks ossia 1,6·10^-10 > 1,1·10^-10
C) K'a > Ka ossia 2,7·10^-5 > 1,75·10^-5
Per l'equilibrio di autoionizzazione dell'acqua la K'w e la Kw coincidono solo per concentrazioni ≤ a 10^-4 M in NaCl.
Per l'equilibrio di solubilità del BaSO4 la K's e la Ks coincidono solo per concentrazioni ≤ a 10^-5 M in NaCl.
Per l'equilibrio di dissociazione del CH3COOH la K'a e la Ka coincidono solo per concentrazioni ≤ a 10^-4 M in NaCl.
Detto in altre parole, le K' sono tanto più elevate quanto maggiore è la forza ionica delle soluzioni e coincidono con le K a forza ionica nulla.
In tutti gli esercizi numerici che coinvolgono gli equilibri in soluzione acquosa si utilizzano le costanti di equilibrio termodinamiche con le attività "facendo finta" che queste coincidano con le costanti di equilibrio con le concentrazioni solo per una ragione di semplificazione nei calcoli.
Detto questo, per capire come è suddivisa la scala in ordinate del grafico vorrei che tu prendessi un foglio a quadretti (non pretendo un foglio di carta millimetrata!!!) e mettessi in grafico i seguenti punti (attenta a quello che leggi!!!)
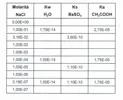
Una volta fatto questo, posta la foto e poi ne riparliamo.
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-03 17:14
LuiCap ha scritto:
Prima di capire come è suddivisa la scala in ordinate del grafico, bisogna che tu abbia chiaro il concetto di costante di equilibrio.
Le costanti di equilibrio termodinamiche sono il rapporto tra le attività dei prodotti elevate al loro coefficiente stechiometrico e le attività dei reagenti elevate al loro coefficiente stechiometrico.
In soluzione acquosa le attività dei solidi e dei liquidi puri è sempre uguale a 1.
Perciò:
Kw = a(H+) · a(OH-) = 1,0·10^-14
Ks = a(Ba2+) · a(SO42-) = 1,1·10^-10
Ka = a(CH3COO-) · a(H+) / a(CH3COOH)
L'attività è una grandezza adimensionale, perciò anche la costante di equilibrio non ha dimensioni.
L'attività coincide con la concentrazione solo quando il coefficiente di attività è unitario:
a = f · C
Il coefficiente di attività è unitario quando la forza ionica della soluzione è nulla.
Se la forza ionica della soluzione non è nulla, la costante di equilibrio in concentrazione, cioè il rapporto tra le concentrazioni dei prodotti elevate al loro coefficiente stechiometrico e le concentrazioni dei reagenti elevate al loro coefficiente stechiometrico, è sempre maggiore della costante di equilibrio in attività.
Questo concetto è rappresentato dal grafico in questione, infatti:
A) K'w > Kw ossia 1,7·10^-14 > 1,0·10^-14
B) K's > Ks ossia 1,6·10^-10 > 1,1·10^-10
C) K'a > Ka ossia 2,7·10^-5 > 1,75·10^-5
Per l'equilibrio di autoionizzazione dell'acqua la K'w e la Kw coincidono solo per concentrazioni ≤ a 10^-4 M in NaCl.
Per l'equilibrio di solubilità del BaSO4 la K's e la Ks coincidono solo per concentrazioni ≤ a 10^-5 M in NaCl.
Per l'equilibrio di dissociazione del CH3COOH la K'a e la Ka coincidono solo per concentrazioni ≤ a 10^-4 M in NaCl.
Detto in altre parole, le K' sono tanto più elevate quanto maggiore è la forza ionica delle soluzioni e coincidono con le K a forza ionica nulla.
In tutti gli esercizi numerici che coinvolgono gli equilibri in soluzione acquosa si utilizzano le costanti di equilibrio termodinamiche con le attività "facendo finta" che queste coincidano con le costanti di equilibrio con le concentrazioni solo per una ragione di semplificazione nei calcoli.
Detto questo, per capire come è suddivisa la scala in ordinate del grafico vorrei che tu prendessi un foglio a quadretti (non pretendo un foglio di carta millimetrata!!!) e mettessi in grafico i seguenti punti (attenta a quello che leggi!!!)
Una volta fatto questo, posta la foto e poi ne riparliamo.
Sì infatti prenderò anche un righello!! Devo prima capire cosa sia la costante e cosa sia la forza ionica, sul libro è stata definita come "proprietà di una soluzione"(...) ma non mi era chiaro se fosse una conseguenza dell'aggiunta di un elettrolita oppure una forza tipo "vettoriale" (non so come dirlo!!!) . Poi le potenze mi mettono in difficoltà: ma perché moltiplico per potenze con esponente positivo a volte e altre con esponente negativo.
Intanto provo a fare il grafico
Rosa
2018-08-04 17:31
Sto impazzendo con le ordinate e le proporzioni per ogni curva  scusi....Ma se faccio 3 grafici separati, ora ne sto facendo 3. Il problema è che se alle ordinate metto un valore piccolissimo con le potenze negative non so come ritrovare questi valori piccoli mi ci vuole una carta millimetrata
scusi....Ma se faccio 3 grafici separati, ora ne sto facendo 3. Il problema è che se alle ordinate metto un valore piccolissimo con le potenze negative non so come ritrovare questi valori piccoli mi ci vuole una carta millimetrata


LuiCap
2018-08-04 18:49
Sono stata un po' "bastarda", lo ammetto, ma era l'unico modo perché tu ci arrivassi da sola, brava!!!
Non occorre che tu prenda la carta millimetrata: è impossibile visualizzare le tre curve sullo stesso piano cartesiano utilizzando un'unica scala in ordinate perché i valori numerici sono compresi in un intervallo numerico di ben 10^9 = 1000000000 ordini di grandezza, da 10^-14 a 10^-5. Le curve relative all'H2O e al BaSO4 "scompaiono" rispetto alla curva del CH3COOH!!!
Per far comparire le tre curve in un unico piano cartesiano gli autori hanno perciò eliminato la potenza del 10, con l'avvertenza però di moltiplicare i valori numerici di ogni curva per tre diversi fattori:
A) x 10^-14
B) x 10^-10
C) x 10^-5
Mi accorgo ora che, a mio parere, è un refuso di stampa aver scritto x 10^14, x 10^10, x 10^-5.
Anche la scala in ascissa non è lineare, ma ad intervalli. Mi correggo, l'ascissa è in scala logaritmica. 

Anch'io faccio schifo a disegnare curve a mano libera. 
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-04 19:00
Grazie mille ma quale schifo !!! I suoi appunti son sempre chiari! Poi non definisca se stessa con questi brutti termini!
Grazie
Rosa
2018-08-04 20:01
forse non è un refuso di stampa perché anche nel commento dell'autore che avevo allegato le potenze sono espresse in valori positivi? Magari è stata una scelta comoda per non lavorare con potenze negative no?(la sto ultrastressando )
)
LuiCap
2018-08-04 21:00
Lo avevo già letto!!!
Adesso di aver capito adesso: gli autori moltiplicano il valore delle K per la corrispondente potenza del 10 positiva così il valore in ordinata diventa:
A) punto a: Kw = 1,0·10^-14 x 10^14 = 1,0
B) punto b: Ks = 1,1·10^-10 x 10^10 = 1,1
C) punto c: Ka = 1,75·10^-5 x 10^5 = 1,75
I valori di K' all'aumentare della concentrazione di NaCl diventano:
A) punto a': K'w = 1,7 x 10^14 che riportato nella scala reale diventa 1,7·10^-14
B) punto b': K's = 1,6 x 10^10 che riportato nella scala reale diventa 1,6·10^-10
C) punto c': K'w = 1,75 x 10^5 che riportato nella scala reale diventa 1,75·10^-5
Cerca però di afferrare il concetto di base, che non è l'artificio con il quale hanno costruito il grafico ma:
A) all'aumentare della concentrazione di NaCl, cioè all'aumentare della forza ionica della soluzione, la Kw aumenta da 1,0·10^-14 a 1,7·10^-14
B) all'aumentare della concentrazione di NaCl, cioè all'aumentare della forza ionica della soluzione, la Ks aumenta da 1,1·10^-10 a 1,6·10^-10
C) all'aumentare della concentrazione di NaCl, cioè all'aumentare della forza ionica della soluzione, la Ka aumenta da 1,75·10^-5 a 2,7·10^-5
Le K e le K' sono tutte dei valori <<<1 perché gli equilibri di dissociazione di H2O, BaSO4(s) e CH3COOH sono tutti molto spostati verso i reagenti.
Ora non ti resta da capire bene cos'è la forza ionica!!!
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-04 21:03
Infatti imparare la formulina di forza ionica solo non serve, avevo letto il fatto delle interazioni elettrostatiche ma non mi riveli il concetto Lei 
Mi impegnerò per capirlo sola altrimenti che fa tutto Lei??!
Rosa
2018-08-08 13:25
Scusi sto studiando la forza ionica, mi sorge però un dubbio nella definizione: affermare che la "forza ionica sia l'intensità del campo elettrico generato dalle cariche presenti nella soluzione(..., fonte sito chimicamo.org)" è corretto ?la mia confusione nasce dalle unità di misura. La forza ionica si misura come M, moli su L , quindi come una concentrazione, associarla all'intensità del campo elettrico mi dà l'idea di N/Coulomb, mi ricorda un vettore ma la forza ionica non è vettoriale no?... Ho difficoltà a scrivere in maniera chiara la definizione di forza ionica
LuiCap
2018-08-08 18:13
La forza ionica µ è una misura della concentrazione totale degli ioni in una soluzione:
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-08 18:44
Ma quindi il campo elettrico menzionato in quella definizione non c'entra nulla?
LuiCap
2018-08-08 19:29
C'entra nel senso che maggiore è la forza ionica della soluzione, minore è il coefficiente di attività di un determinato ione, quindi, tanto minore è la sua attività rispetto alla concentrazione molare.
Per quanto riguarda il grafico ho corretto una mia risposta precedente: in ascissa c'è una scala logaritmica. 
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-20 21:47
LuiCap ha scritto:
C'entra nel senso che maggiore è la forza ionica della soluzione, minore è il coefficiente di attività di un determinato ione, quindi, tanto minore è la sua attività rispetto alla concentrazione molare.
Per quanto riguarda il grafico ho corretto una mia risposta precedente: in ascissa c'è una scala logaritmica.

Al diminuire delle attività perché la forza ionica non diminuisce?
LuiCap
2018-08-21 16:52
Rosa ha scritto:
Al diminuire delle attività perché la forza ionica non diminuisce?
Da dove nasce questo tuo dubbio? Da una frase letta o da un tuo calcolo?
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-21 18:49
LuiCap ha scritto:
C'entra nel senso che maggiore è la forza ionica della soluzione, minore è il coefficiente di attività di un determinato ione, quindi, tanto minore è la sua attività rispetto alla concentrazione molare.
Per quanto riguarda
Da questa frase che cito
LuiCap
2018-08-21 19:22
Il coefficiente di attività (γ) è la costante di proporzionalità diretta che lega l'attività di un singolo ione (Ai) con la sua concentrazione molare (Ci):
Ai = γ · Ci
Più la soluzione è diluita, minore è la forza ionica, quindi il log γ, tende a 0 e γ tende a 1.
In soluzione diluita, perciò, l'attività tende a coincidere con la concentrazione e la costante di solubilità delle concentrazioni tende a comportarsi come una vera costante di equilibrio, cioè una costante termodinamica.
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-22 21:21
Scusi ma non riesco a commentare questo grafico perché ci sono due curve fatte così? 
In pratica aggiungo l'elettrolita quindi la solubilità aumenta (curva verde)?
Invece all'aggiunta del sale con lo ione comune la solubilità diminuisce no?e in tutto ciò questa forza ionica come la inserisco nel discorso?
LuiCap ha scritto:
maggiore è la forza ionica della soluzione, minore è il coefficiente di attività di un determinato ione, quindi, tanto minore è la sua attività rispetto alla concentrazione molare.
Scusi mi sembra di aver capito questo concetto citato, ma se volessi dimostrarlo attraverso delle formule sfrutto la legge di Debye e Huckel?
LuiCap
2018-08-23 14:27
Scusi ma non riesco a commentare questo grafico perché ci sono due curve fatte così? 
In pratica aggiungo l'elettrolita quindi la solubilità aumenta (curva verde)?
Invece all'aggiunta del sale con lo ione comune la solubilità diminuisce no? e in tutto ciò questa forza ionica come la inserisco nel discorso?
La curva superiore mostra come varia la solubilità dell'AgIO3(s) al variare della concentrazione della concentrazione di un elettrolita (KNO3) che non ha ioni in comune con il composto poco solubile. I punti sperimentali (circles) sono stati ottenuti sperimentalmente, ossia sono state preparate diverse soluzioni sature di AgIO3 in soluzioni di KNO3 via via crescenti e poi con un qualche metodo analitico (che so, ma che ti risparmio  ) è stata determinata la concentrazione di IO3- nelle diverse soluzioni sature. Questa concentrazione corrisponde alla solubilità dell'AgIO3 in KNO3 a varie concentrazioni. Si osserva che all'aumentare della concentrazione del KIO3 aumenta, anche se di poco (curva poco pendente), aumenta la solubilità dell'AgIO3.
) è stata determinata la concentrazione di IO3- nelle diverse soluzioni sature. Questa concentrazione corrisponde alla solubilità dell'AgIO3 in KNO3 a varie concentrazioni. Si osserva che all'aumentare della concentrazione del KIO3 aumenta, anche se di poco (curva poco pendente), aumenta la solubilità dell'AgIO3.
Questo accade perché all'aumentare della concentrazione del KNO3 aumenta la forza ionica della soluzione, di conseguenza, in base alla legge di Debye - Hückel, diminuisce il coefficiente di attività degli ioni Ag+ e IO3(-); affinché l'attività degli ioni Ag+ e IO3(-) resti costante, deve per forza aumentare la loro concentrazione nella soluzione satura:
Ai = γ · Ci............ se γ diminuisce, Ci deve aumentare.
La curva inferiore mostra come varia la solubilità dell'AgIO3(s) al variare della concentrazione di un elettrolita (KIO3) che ha uno ione in comune (IO3-) con il composto poco solubile. I punti che giacciono sulla curva sono stati calcolati, cosa che ti chiedo di fare, ovviamente se hai tempo e voglia:
Sapendo che la Ks di AgIO3 è 3,1·10^-8 calcola la solubilità del composto poco solubile in:
- acqua
- KIO3 1 mmol/L
- KIO3 2 mmol/L
- KIO3 4 mmol/L
- KIO3 6 mmol/L
- KIO3 8 mmol/L
- KIO3 12 mmol/L
- KIO3 16 mmol/L
Con i valori calcolati costruisci il grafico mettendo in ascisse la concentrazione del KIO3 in mmol/L e in ordinate la solubilità dell'AgIO3 in mmol/L.
Calcola la forza ionica di ciascuna soluzione.
Scusi mi sembra di aver capito questo concetto citato, ma se volessi dimostrarlo attraverso delle formule sfrutto la legge di Debye e Huckel?
Certamente sì.
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-23 14:51
[quote='LuiCche so, ma che ti risparmio ) è stata determinata la concentrazione di IO3- cisse la concentrazione del KIO3 in mmol/L e in ordinate la solubilità dell\'AgIO3 in mmol/L.' pid='101121' dateline='1535034464']
Calcola la forza ionica di ciascuna soluzione.
Scusi mi sembra di aver capito questo concetto citato, ma se volessi dimostrarlo attraverso delle formule sfrutto la legge di Debye e Huckel?
Certamente sì.
E lo so che lo sa ci mancherebbe! Grazie mille li farò sto finendo il capitolo delle slides sulla precipitazione frazionata appena finisco tutto il modulo mi dedico a questi esercizi. Grazie mille
Rosa
2018-08-30 12:14
LuiCap ha scritto:
Scusi ma non riesco a commentare questo grafico perché ci sono due curve fatte così?

In pratica aggiungo l'elettrolita quindi la solubilità aumenta (curva verde)?
Invece all'aggiunta del sale con lo ione comune la solubilità diminuisce no? e in tutto ciò questa forza ionica come la inserisco nel discorso?
La curva superiore mostra come varia la solubilità dell'AgIO3(s) al variare della concentrazione della concentrazione di un elettrolita (KNO3) che non ha ioni in comune con il composto poco solubile. I punti sperimentali (circles) sono stati ottenuti sperimentalmente, ossia sono state preparate diverse soluzioni sature di AgIO3 in soluzioni di KNO3 via via crescenti e poi con un qualche metodo analitico (che so, ma che ti risparmio
) è stata determinata la concentrazione di IO3- nelle diverse soluzioni sature. Questa concentrazione corrisponde alla solubilità dell'AgIO3 in KNO3 a varie concentrazioni. Si osserva che all'aumentare della concentrazione del KIO3 aumenta, anche se di poco (curva poco pendente), aumenta la solubilità dell'AgIO3.
Questo accade perché all'aumentare della concentrazione del KNO3 aumenta la forza ionica della soluzione, di conseguenza, in base alla legge di Debye - Hückel, diminuisce il coefficiente di attività degli ioni Ag+ e IO3(-); affinché l'attività degli ioni Ag+ e IO3(-) resti costante, deve per forza aumentare la loro concentrazione nella soluzione satura:
Ai = γ · Ci............ se γ diminuisce, Ci deve aumentare.
La curva inferiore mostra come varia la solubilità dell'AgIO3(s) al variare della concentrazione di un elettrolita (KIO3) che ha uno ione in comune (IO3-) con il composto poco solubile. I punti che giacciono sulla curva sono stati calcolati, cosa che ti chiedo di fare, ovviamente se hai tempo e voglia:
Sapendo che la Ks di AgIO3 è 3,1·10^-8 calcola la solubilità del composto poco solubile in:
- acqua
- KIO3 1 mmol/L
- KIO3 2 mmol/L
- KIO3 4 mmol/L
- KIO3 6 mmol/L
- KIO3 8 mmol/L
- KIO3 12 mmol/L
- KIO3 16 mmol/L
Con i valori calcolati costruisci il grafico mettendo in ascisse la concentrazione del KIO3 in mmol/L e in ordinate la solubilità dell'AgIO3 in mmol/L.
Calcola la forza ionica di ciascuna soluzione.
Scusi mi se
Ho svolto l'esercizio adattandolo alle domande del prof (questo tipo di esercizio non prevede il disegno del grafico allo scritto) per cui bisogna usare i riferimenti ai valori di alfa (funzione di distribuzione) come negli esempi allegati.
Ho accorciato i punti del problema da eseguire perché vorrei capire se ho imparato il metodo a prescindere dai singoli valori;
ho cambiato l'esercizio così:
"Sapendo che la Ks di AgIO3 è 3,1·10^-8 calcola la solubilità del composto poco solubile in:
- acqua
- KIO3 1 mmol/L
- KIO3 2 mmol/L
- KIO3 16 mmol/L
Calcola la forza ionica di ciascuna soluzione. E vorrei se per Lei va bene aggiungere questa domanda,
Calcola la solubilità di AgIO3 a pH=2 e pH=3.(domanda molto frequente)". La ringrazio molto
LuiCap
2018-08-31 10:03
I calcoli che hai svolto sono corretti.
Il commento sotto ai valori della forza ionica delle soluzioni di AgIO3 in KIO3 no. Prova tu a trovare l'errore.
Aggiungi pure la risposta all'altra domanda; ti serve però un dato che io non ho scritto. Quale?
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-08-31 10:32
LuiCap ha scritto:
I calcoli che hai svolto sono corretti.
Il commento sotto ai valori della forza ionica delle soluzioni di AgIO3 in KIO3 no. Prova tu a trovare l'errore.
Aggiungi pure la risposta all'altra domanda; ti serve però un dato che io non ho scritto. Quale?
Prova tu a trovare l'errore.
La forza ionica aumenta e non la solubilità?
Aggiungi pure la risposta all'altra domanda; ti serve però un dato che io non ho scritto. Quale?
la ka di HIO3?
Rosa
2018-09-01 08:13
A pH 2 ho fatto. Però la domanda a pH 3 la vorrei modificare con un sale derivato da un acido diprotico va bene?
Rosa
2018-09-01 08:55
Ho finito anche la seconda domanda ma ho usato il cromato di argento. Nel calcolo delle alfa ho scelto alfa2? È giusto? Oppure dovevo usare alfa1?può dirmi in base a cosa scelgo un' alfa al posto di un'altra? Il prof disse in base alla specie prevalente a quel pH che possiamo osservare sul diagramma di distribuzione. Tuttavia io sul diagramma di un acido diprotico vedo che la specie prevalente a pH 2 sia H2M come ho sottolineato nella foto . Scusi mi potrebbe dare delucidazioni? La ringrazio
LuiCap
2018-09-02 14:22
Secondo te quel grafico di distribuzione che hai allegato è riferito all'H2CrO4??? Da cosa lo deduci???
Rosa
2018-09-02 15:08
 perché per gli acidi diprotici il grafico non è sempre quello?
perché per gli acidi diprotici il grafico non è sempre quello?
LuiCap
2018-09-02 15:38
Rosa, non è possibile che dopo tremila esercizi e cinquemila grafici logaritmici per un acido diprotico tu mi faccia questa domanda. 
Cosa rappresentano i punti di incrocio delle curve nel grafico di alfa in funzione del pH???
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-09-02 15:43
Le pka son diverse 
LuiCap
2018-09-02 15:47
Appunto.
Senza bisogno di costruire il grafico alfa/pH o il grafico logaritmico, sei in grado di calcolare i valori numerici di alfa per H2CrO4, HCrO4(-) e CrO4(2-) a pH = 3 come è indicato nel testo dell'esercizio???
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-09-02 16:10
Non so se sono sbagliati i calcoli frettolosi 
LuiCap
2018-09-02 16:30
Bene.
Allora quale è la specie predominante a pH 3???
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-09-02 16:57
Alfa1? Ma il prof e anche la slides su un esercizio simile ovvero con Ag2C2O4 dicono di usare alfa2 quindi non capisco
LuiCap
2018-09-02 19:37
In entrambi gli esercizi la specie prevalente al pH considerato è HA- perché è quella che possiede il valore maggiore della frazione di distribuzione alfa.
Io sinceramente smetterei di numerare gli alfa perché si fa solo della confusione.
In ogni caso per come ragiono io:
- se chiamiamo alfa 0 la frazione di distribuzione di H2A, allora quella di HA- sarà alfa 1 e quella di A2- sarà alfa 2
- se chiamiamo alfa 0 la frazione di distribuzione di A2-, allora quella di HA- sarà sempre alfa 1 e quella di H2A sarà alfa 2.


I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-09-02 20:05
Ma il prof ha insistito su questo fatto che bisogna considerare l'ultima specie dissociata in quanto prevalente. Il problema è che a me non sembra coerente. Lei che ne pensa?  La sto torturando La prego di scusarmi
La sto torturando La prego di scusarmi
LuiCap
2018-09-03 17:46
Eppure lo dovrei sapere che a una certa età non ci si può arrampicare per sentieri tortuosi perché manca il fiato!!! 
Scusami se ti ho fatto confusione e fatto perdere tempo prezioso.
Non considerare i due ultimi allegati, l'esercizio dell'Ag2CrO4 è sbagliato e ci sono anche degli errori di calcolo (alfa CrO4(2-) è 3,23·10^-4 e non 1,08·10^-5 come ho scritto), quello dell'Ag2C2O4 pure, ma il risultato concorda solo per una pura fatalità: la [H+]^2 ha lo stesso valore numerico della Ka2 dell'acido debole, 10^-4.
In entrambi gli esercizi al pH acido considerato la specie prevalente di un acido H2A è sicuramente HA-.
Questo significa che, in presenza di H+, l'anione A2- del sale poco solubile reagisce con gli H+ fermandosi ad HA-:
Ag2A(s) <--> 2 Ag+ + A2-
A2- + H+ <--> HA-...........avviene
HA- + H+ <--> H2A..........non avviene
Di conseguenza per calcolare la Ks condizionale bisogna utilizzare il valore di alfa A2- e non quello di HA- come ho erroneamente scritto.
Salvo nuovi errori sempre in agguato, i miei calcoli sono questi:
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa
Rosa
2018-09-03 19:45
LuiCap ha scritto:
Eppure lo dovrei sapere che a una certa età non ci si può arrampicare per sentieri tortuosi perché manca il fiato!!!

Scusami se ti ho fatto confusione e fatto perdere tempo prezioso.
Non considerare i due ultimi allegati, l'esercizio dell'Ag2CrO4 è sbagliato e ci sono anche degli errori di calcolo (alfa CrO4(2-) è 3,23·10^-4 e non 1,08·10^-5 come ho scritto), quello dell'Ag2C2O4 pure, ma il risultato concorda solo per una pura fatalità: la [H+]^2 ha lo stesso valore numerico della Ka2 dell'acido debole, 10^-4.
In entrambi gli esercizi al pH acido considerato la specie prevalente di un acido H2A è sicuramente HA-.
Questo significa che, in presenza di H+, l'anione A2- del sale poco solubile reagisce con gli H+ fermandosi ad HA-:
Ag2A(s) <--> 2 Ag+ + A2-
A2- + H+ <--> HA-...........avviene
HA- + H+ <--> H2A..........non avviene
Di conseguenza per calcolare la Ks condizionale bisogna utilizzare il valore di alfa A2- e non quello di HA- come ho erroneamente scritto.
Salvo nuovi errori sempre in agguato, i miei calcoli sono questi:
Ma scusi Lei per il tempo ci mancherebbe altro 
Ricapitolando: siccome ho solo due ore e devo fare 6 esercizi (considerando grafici logaritmici ecc e disegnini vari) non posso per ogni cosa pretendere di fare tutti i ragionamenti sui perché quindi secondo Lei per accorciare i tempi posso usare come regola mnemonica(non mi mangi) la seguente : in presenza di sali di acidi diprotici a pH acidi uso la alfa2 perché il protagonista della reazione con gli H+ è l'anione completamente dissociato che mi rende HA- la specie prevalente. Ma questo anione a pH acidi idrolisi basica?