ClaudioG.
2019-03-27 22:38
Buonasera 
riporto qui una piccola e semplicissima dimostrazione che ho fatto quest'estate (ma ho avuto solo ora il tempo di scriverci su), classicamente eseguita anche nelle scuole secondarie per insegnare i rudimenti della fisiologia vegetale. Si tratta di verificare in modo semplice gli effetti che la privazione della luce ha sulla produzione vegetale di amido. La questione si potrebbe espandere molto, valutando tempistiche, variazioni microscopiche, etc., e si potrebbe affiancare ad altri esperimenti istruttivi, ma non ho avuto tempo di far nulla in merito.
Le piante, lo sappiamo, sono in grado di produrre composti biomolecolari ad alto contenuto energetico tramite fissazione dell'anidride carbonica dell'atmosfera, in un processo reso autonomo e possibile dall'energia solare. Tali composti vengono poi utilizzati dalla pianta per le immediate necessità metaboliche o stoccati per usi futuri. Per spiegare i risultati del piccolo esperimento è doveroso accennare qui agli eventi che guidano questo meraviglioso e vitale processo, la fotosintesi ossigenica. Spendo quindi un paio di parole, molto molto grossolanamente, per chiarire questo lavoretto, e allego comunque le pagine dei miei riassunti di Fisiologia vegetale in cui è trattata la fotosintesi. In questo modo chi è più curioso può leggere direttamente lì i moltissimi dettagli che non ho scritto qui per questioni di tempo.
Riassunti sulla fotosintesi (cliccare sul link drive, non potevo allegarlo perché troppo pesante): si tratta solo della porzione dei miei riassunti relativa alla fotosintesi (sono incluse delle parti sulla fotorespirazione e sul metabolismo C4 e CAM, se possono interessare), ma se qualcuno ha bisogno di altre parti della fisiologia vegetale basta chiedere : Gli studiosi e appassionati di biologia vegetale che leggono perdoneranno a un povero biotecnologo la magrezza di dettagli e l'approssimazione (la Vegetale noi la facciamo di passaggio, in un piccolo corso da 3 cfu)
Gli studiosi e appassionati di biologia vegetale che leggono perdoneranno a un povero biotecnologo la magrezza di dettagli e l'approssimazione (la Vegetale noi la facciamo di passaggio, in un piccolo corso da 3 cfu)
https://drive.google.com/open?id=11hLWE67t_hXhD3cNXI2JUjB4EKygrIhC
Cenni teorici
La cellula vegetale è un capolavoro di efficienza e durabilità, che differisce per molti aspetti morfofunzionali da quella animale. Quello che interessa a noi però sono i cloroplasti, cioè i compartimenti cellulari specializzati nei quali si attua la fotosintesi. Si tratta di sacchetti larghi al massimo 10 um, delimitati esternamente da una doppia membrana, e che contengono una matrice fluida, detta stroma, nella quale è immersa una rete di vescicole membranose impilate e interconnesse, dette tilacoidi. La fotosintesi avviene tutta nello stroma e a cavallo della membrana tilacoidale. In generale, si parte da acqua, anidride carbonica ed energia solare, e si ottengono ossigeno elementare e gliceraldeide 3-fosfato. Quest'ultima voi chimici la conoscete bene perché è la versione fosforilata del trioso precursore della serie dei carboidrati aldosi, ed è infatti da questa che iniziano i processi di sintesi dei glucidi più complessi, tra cui l'amido. Comunque diciamo subito che la fotosintesi opera in due fasi sequenziali, chiamate fase luminosa e fase al buio. Di seguito un piccolo schema dal web per fare chiarezza:
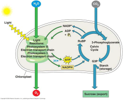
Nella fase luminosa, la luce viene assorbita da pigmenti fotosintetici, cioè clorofille, caroteni e altri composti con sistemi di polieni coniugati. La varietà di questi pigmenti consente di assorbire uno spettro relativamente ampio di lunghezze d’onda.
I pigmenti così eccitati sfruttano il loro stato energetico per trasferire elettroni (derivanti dalla scissione dell'acqua in ossigeno molecolare -rilasciato in forma gassosa-, protoni ed elettroni) attraverso una serie di complessi proteici immersi nella membrana, e questo passaggio provoca:
a) riduzione del NADP+ in NADPH
b) pompaggio di protoni nel lume tilacoidale. Questi protoni pompati, sommati a quelli derivanti dalla scissione dell'acqua, generano un gradiente protonico transmembrana (NB i doppi strati fosfolipidici, di cui son composte le membrane, sono impermeabili agli ioni). I protoni, spinti dal gradiente, vengono lasciati passare nello stroma tramite l'ATPsintasi, che accoppia questo passaggio passivo alla fosforilazione dell'ADP in ATP.
Il NADPH e l'ATP (per chi non lo sapesse sono, rispettivamente, un utile trasportatore di elettroni necessario alle riduzioni biologiche e un nucleoside trifosfato che, defosforilandosi, libera molta energia utile alle biosintesi) entrano nella fase al buio.
La fase al buio consiste nella fissazione della CO2 tramite la carbossilazione (mediata da un'interessantissimo enzima, la RuBisCO) del ribulosio 1,5-fosfato in 2 molecole di 3-fosfoglicerato. Queste ultime vengono convertite, in due tappe (è quì che vengono usati ATP e NADPH prodotti nella fase luminosa), in due molecole di gliceraldeide 3-fosfato (G3P). Solo una frazione (1/6) della G3P prodotta viene indirizzata alla sintesi di molecole più complesse, perché la rimanente va a ricostituire il ribulosio 1,5-fosfato, che può essere ricarbossilato in un processo ciclico (ciclo di Calvin). Comunque, a noi interessa il destino biosintetico di quella piccola quota di G3P, che può:
→ Essere esportata dal cloroplasto per dare, alla fine, saccarosio e polisaccaridi della parete cellulare
→ Rimanere nel cloroplasto per essere convertita, in una serie di reazioni, in glucosio 1-fosfato, che polimerizza a dare l'amido, principale riserva energetica della pianta. L'amido prodotto si accumula poi in organelli specializzati, gli amiloplasti.
Tutti questi processi di fase luminosa e al buio (descritti un po' più nel dettaglio nel pdf in allegato e ancora più nel dettaglio in un buon libro di biochimica) sono riassumibili nella ben nota semplificazione:
H2O + CO2 + LUCE → G3P (quindi GLUCOSIO, quindi AMIDO) + O2
La fase luminosa, quindi, produce ATP e potere riducente da utilizzare nella fase al buio. Va specificato in effetti che la fase al buio, pur avendo questo nome, può funzionare al buio solo per breve tempo, essendo strettamente dipendente dai prodotti ad alta energia della fase luminosa. In estrema sintesi diciamo che le piante, per fare e rinnovare amido, hanno bisogno della luce.
Materiali
- Alluminio in fogli
- Acqua di rubinetto
- Becher capiente e provettone/becher più piccolo
- Piastra riscaldante (no fiamma!)
- Etanolo 95% (ma va bene anche al 90%)
- Reattivo di Lugol, da usare un diluito secondo la convenienza (va bene anche il Betadine commerciale, previa diluizione)
- Vaschette/piastre petri
Procedura
Questo esperimentino consiste nell'oscurare per qualche giorno una foglia vivente per poi prelevarla, rimuoverne la clorofilla con etanolo (per decolorare la foglia ed evitare interferenze) e fare un saggio di Lugol su essa e su una foglia di controllo (decolorata ma non oscurata).
Il saggio di Lugol sulle foglie decolorate (adattato anche per osservazioni microscopiche di amiloplasti) è tuttora un valido sistema, usato dai biologi vegetali, per valutare la produzione di amido nelle piante sottoposte a particolari condizioni. Si basa, come ben sapete, sul colore viola conferito all'amido dallo iodio che ne penetra le eliche di amilosio.
1. Scegliere una pianta comoda, dalle foglie chiare e non troppo rigide (io ho scelto la vite che sta dietro casa), e selezionarne una foglia (foglia A) in buona salute. Dalla mattina, coprire in modo aderente con del foglio di alluminio metà della foglia, usando se necessario due pezzetti di carta gommata per tener ferma la copertura. Per veder meglio il risultato è bene fare un margine netto tra la parte coperta e quella alla luce;
2. Passati due giorni, staccare la foglia A insieme a un'altra foglia (foglia B) di controllo, di dimensioni e forma possibilmente simili. Marcare con una fascetta o un piccolo taglio la foglia A, così da poterla poi distinguere;
3. Rimuovere delicatamente la copertura dalla foglia A (si nota, foto a sx, che le foglie sono completamente indistinguibili in termini di colorazione), e inserire entrambe le foglie in un becher con acqua quasi-bollente, tenendole immerse (aiutandosi con delle pinzette se serve) per 1 minuto (foto a dx). Questo trattamento indebolisce i tessuti vegetali, facilitando la decolorazione. Nel frattempo, inserire a bagnomaria nello stesso becher un provettone (o un altro becher) contenente etanolo 95%;


4. Passato un minuto, trasferire le due foglie nel provettone con l'etanolo, che dovrà essere bollente. Mantenerle immerse per 4/5 min, osservando che la foglia si schiarisce, cedendo il colore verde al solvente;
5. Rimuovere le foglie dall'alcol e sciacquarle con acqua fredda. Distenderle, ancora umide, su due piastre Petri abbastanza capienti o in una vaschetta di plastica: si presentano bianche/giallognole, come in foto;
6. Versare sulle foglie, coprendole interamente, la soluzione diluita di Lugol e attendere pochi minuti (5 dovrebbero bastare). Sciacquare le due foglie e depositarle su un supporto bianco per vedere i risultati. Dovrebbero presentarsi come nella foto a dx;


Risultati
Come atteso, la foglia A, quella tenuta al buio, dà un esito negativo per la presenza di amido sulla sua superfice non esposta alla luce. Le cellule di quella porzione di foglia non hanno ricevuto sufficiente energia luminosa per mandare avanti la fase buia della fotosintesi, e sono rimaste prive di amido (quello residuo è stato utilizzato dalle stesse cellule per sopravvivere nell'oscurità). Di seguito le foto delle foglie tra due vetri contro un muro bianco e poi controluce, un dettaglio del confine tra l'area deamidata e quella normale, e l'aspetto delle foglie una volta asciutte.




I seguenti utenti ringraziano ClaudioG. per questo messaggio: TrevizeGolanCz, FLaCaTa100, luigi_67, LuiCap, Nico, EdoB, zodd01, Roberto, ohilà, Claudio, Copper-65, arkypita, NaClO, Igor, thenicktm, Beefcotto87



