Guido_00
2023-03-13 19:01
Propongo il seguente esercizio e la mia risoluzione.
Traccia --> Calcolare la concentrazione di H+, ClO2- ed HClO2 in una soluzione ottenuta sciogliendo 0,02 moli di HClO2 in un litro di soluzione 0,01 M di NaCl02. La costante di ionizzazione di HClO2 è pari a 1,1 x 10^-2 mol/litro.
Prima di esporre il mio ragionamento, volevo sottolineare che il mio dubbio riguarda se il litro di soluzione riguarda solo NaClO2 (caso 1) o NaClO2 + HClO2 (caso 2), nel primo caso caso avrei difficoltà con la risoluzione!
CASO 2 --> Riporto la dissociazione del clorito di sodio NaClO2 --> Na+ + ClO2- per cui [ClO2-] = [NaClO2] = 0,01 M, riguardo l'acido cloroso esso si dissocia debolmente per cui HClO2 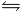 H+ + ClO2- , dalle moli di HClO2 ho ricavato la concentrazione iniziale ovvero [ HClO2] =0,02 M a questo punto impostando la tabella di reazione e sostituendo nella legge di azione di massa ottengo 1,1 x 10^-2 = [x (0,01 x)] / (0,02 - x) ottenendo da qui x e le concentrazioni richieste!
H+ + ClO2- , dalle moli di HClO2 ho ricavato la concentrazione iniziale ovvero [ HClO2] =0,02 M a questo punto impostando la tabella di reazione e sostituendo nella legge di azione di massa ottengo 1,1 x 10^-2 = [x (0,01 x)] / (0,02 - x) ottenendo da qui x e le concentrazioni richieste!
CASO 1 -->Riporto la dissociazione del clorito di sodio NaClO2 --> Na+ + ClO2- per cui [ClO2-] = [NaClO2] = 0,01 M, dunque le moli del clorito di sodio e quelle dello ione di cloro sono 0,01 mol, riguardo l'acido cloroso esso si dissocia debolmente per cui HClO2 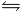 H+ + ClO2-, quindi all'inzio abbiamo 0,02 moli, a questo punto impostando la tabella di reazione e sostituendo nella legge di azione di massa ottengo 1,1 x 10^-2 = [x (0,01 x)] / (0,02 - x) ottenendo da qui x ma a questo punto, nota x, conosco all'equilibrio le moli di HClO2, di H+ e di ClO2- ma come faccio a determinare le concentrazioni visto che conosco solo il volume di NaClO2 pari ad 1 litro e non quella soluzione NaClO2 + HClO2?
H+ + ClO2-, quindi all'inzio abbiamo 0,02 moli, a questo punto impostando la tabella di reazione e sostituendo nella legge di azione di massa ottengo 1,1 x 10^-2 = [x (0,01 x)] / (0,02 - x) ottenendo da qui x ma a questo punto, nota x, conosco all'equilibrio le moli di HClO2, di H+ e di ClO2- ma come faccio a determinare le concentrazioni visto che conosco solo il volume di NaClO2 pari ad 1 litro e non quella soluzione NaClO2 + HClO2?
Grazie per l'attenzione