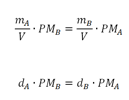Buongiorno, stavo cercando la densità molecolare di un fluido come il vapore o meglio ancora l'areosol, ammesso che si tratti di due fluidi diversi come densità, e mi chiedevo appunto se esiste una tabella che rappresenti le diverse densità molecolari, cioè la quantità di molecole, dallo stato liquido a quello gassoso del vapore acqueo.
Inoltre volevo conoscere se allo stato gassoso le molecole sono comunque legate fra di loro. Mille grazie.
Buongiorno a tutti,
avevo già accennato avrei aperto una discussione su un metodo semplice per la determinazione del peso molecolare ed eccolo qua.
Il metodo prevede la determinazione del peso molecolare misura la densità del vapore di una sostanza. Diciamo subito che è applicabile a sostanze gassose o facilmente gassificabili.
Questo che sto per esporvi è il metodo principe per la determinazione del peso molecolare ed è quello usato da Cannizzaro a sostegno della teoria atomica e molecolare. Ho esposto la teoria di questo grande genio italiano in un'altra discussione a cui vi rimando.
Ma cosa c'entra la densità del vapore con il peso molecolare ? Ebbene adesso vedremo la spiegazione teorica, la trattazione matematica e poi il procedimento vero e proprio.
La spiegazione teorica parte dalla chimica dei gas, da Avogadro e dalla sua ipotesi secondo il quale volumi uguali di gas diversi nelle medesime condizioni di temperatura e pressione contengono lo stesso numero di particelle. La portata di questa ipotesi è immensa ma non estenderemo oltre la spiegazione perchè ne ho parlato nella discussione sulla teoria atomica e vi rimando lì nuovamente.
Qui ci limiteremo a dire che la conseguenza di questa ipotesi è che la massa di un determinato volume di un gas A moltiplicata al peso molecolare del gas B è uguale alla massa del medesimo volume di gas B ( nelle stesse condizioni di pressione e temperatura ) moltiplicata per il peso molecolare del gas A.
Scriviamo:
Ma la massa dei due gas normalizzati allo stesso volume cos'è se non la densità ? Siccome fu l'idrogeno scelto come riferimento al peso molecolare del gas B sostituiamo quello dell'idrogeno cioè 2. Riarrangiando la formula abbiamo che per sapere il peso molecolare di una sostanza basta misurare la densità del suo gas a una determinata pressione e temperatura, dividerla per la densità che avrebbe lo stesso volume di idrogeno nelle medesime condizioni ( calcolata con la formula dei gas ideali ) e moltiplicare per due.
Tuttavia c'è un'altra giustificazione matematica. Dalla ipotesi di Avogadro deriva la legge dei gas ideali nella quale compaiono le moli. Sostituendo queste col loro valore cioè g / PM e riarrangiando abbiamo:
Ok, benissimo e bellissimo ma come si esegue la misura ?
E' molto semplice, occorrono:
- 1 siringa di vetro da 100 ml per gas con setto di gomma con divisione al ml
- 1 termometro
- un bagno di acqua bollente
- un barometro
- una siringa
- una bilancia al mg
Se il nostro composto è gassoso allora basta riempire la siringa per gas di un determinato volume di composto, pesarla, sottrarre la tara, misurare temperatura e pressione. Poi calcolarsi la densità che avrebbe l'idrogeno in quelle condizioni tramite la formula dei gas ideali.
Se invece il nostro composto è un liquido volatile allora procediamo così: con la siringa di vetro aspiriamo 5 - 10 ml di aria, mettiamo il setto di gomma e immergiamo in un bagno di acqua bollente. A parte aspiriamo 1 - 2 ml di composto con una siringa qualunque e la pesiamo sulla bilancia. Una volta che il pistone della siringa per gas ha smesso di espandersi registriamo il volume finale ed iniettiamo tramite il setto di gomma 0,2 ml di composto e riponiamo nel bagno bollente. Ripesiamo la siringa col composto. Quando nuovamente smette di espandersi vuol dire che la temperatura dei gas all'interno della siringa è uguale a quella del bagno ( che misuriamo col termometro ) così come la pressione all'interno è uguale a quella esterna ( che misuriamo col barometro ).
Usando la formula dei gas ideali riarrangiata e riportando tutte le grandezze alle unità di misura adatte ( temperatura in K, pressione in mmHg ) troviamo il peso molecolare. Per massa usiamo la differenza di peso della siringa col composto prima e dopo l'iniezione, per volume usiamo la differenza fra il volume della siringa per gas dopo l'iniezione e prima.
Ripetere l'esperienza tre volte e fare la media.
Ho trovato un video che mostra benissimo come si fa
https://www.youtube.com/watch?v=TibBoc5l2DY
Considerazioni finali
Questo metodo ha ovviamente dei limiti. Il primo è come già detto che può essere applicato a sostanze gassose o facilmente gassificabili. Composti che si decompongono con la temperatura non possono essere trattati così come quelli con un p.eb. troppo alto.
Essendo che usiamo un bagno di acqua possiamo trattare sostanze con p.eb inferiore a quello dell'acqua. Salando il bagno potremmo arrivare a 105 - 110 C ma non oltre perchè il vetro della siringa ci pone un altro limite. Per quanto ne sappia io non ci sono siringhe per gas fatte di pyrex ma al massimo autoclavabili cioè resistenti fino a 120 C.
Questi due limiti frenano questo metodo altrimenti applicabile a una enorme vastità di composti. Comunque è già molto così com'è per noi sperimentatori casalinghi.
Spero di essere stato di aiuto,
Saluti,