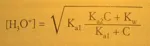Nella formula di dissociazione sqrt[Ka1*(Ka2*C+Kw)/(Ka1+C)]
(scusate ma non so come scrivere le formule matematiche su questo forum)
Kw prodotto ionico viene semplificato(rispetto a Ka2*C) insieme a Ka1 (quest'ultimo trascurabile rispetto a C) numericamente parlando di che cifra si tratta che può essere trascurata?
Grazie a tutti!
Ti riferisci alla formula di come si ricava la [H+] totale di un acido debole diprotico?
Io però non mi trovo con la formula che hai scritto. Come l'hai ricavata?
Secondo me la formula è:
[H+] totale = sqr ((Ka1[H2A]) + (Ka2[HA-]) + Kw)
Dato che [H2A] = [HA-]
[H+] totale = sqr (C(Ka1+Ka2) + Kw)
Ho capito perché non mi trovavo!!!
La formula che hai scritto permette di calcolare la concentrazioni di H+ e quindi il pH non di un acido diprotico H2A, ma della sua base coniugata HA-, che si può comportare sia da acido che da base, quindi è uno ione anfiprotico.
[H+] = sqr ((Ka1·Ka2·C + Ka1·Kw)/(Ka1+C))
Se Ka1>>Kw il secondo termine del numeratore si può trascurare, perciò rimane:
[H+] = sqr ((Ka1·Ka2·C)/(Ka1+C))
Inoltre, se Ka1<<C, si può trascurare anche il primo termine del denominatore:
[H+] = sqr ((Ka1·Ka2·C)/C)
Semplificando C al numeratore e al denominatore si ottiene:
[H+] = sqr (Ka1·Ka2)
da cui pH é:
pH = (pKa1+pKa2)/2
I seguenti utenti ringraziano LuiCap per questo messaggio: R4z0r
ok grazie Luisa e più o meno numericamente parlando che cifra può essere trascurata?