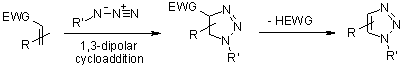quimico
2012-07-21 11:07
"Click Chemistry" è un termine che venne introdotto da K. B. Sharpless nel 2001 per descrivere reazioni che possiedono le seguenti caratteristiche: portano a rese elevate, hanno una vasta applicazione, creano solo sottoprodotti che possono essere rimossi senza cromatografia, sono stereospecifiche, semplici da fare, e possono essere fatte in solventi facilmente rimovibili o non tossici. Questo concetto fu sviluppato in parallelo con l'interesse verso i prodotti farmaceutici, i materiali, e altre tipologie di industria al fine di generare enormi librerie di composti per lo screening nella ricerca e sviluppo. Diversi tipi di reazioni che rispondono ai criteri citati sopra sono stati identificati; si tratta di reazioni favorite termodinamicamente, reazioni che portano ad un solo prodotto, come le reazioni di apertura nucleofila di epossidi ed aziridine, reazioni al carbonile non aldoliche, come la formazione di idrazoni ed eterocicli, addizioni a legami multipli carbonio-carbonio, come la formazione ossidativa di epossidi e le addizioni di Michael, e le reazioni di cicloaddizione.
Per esempio, un'analisi della cicloaddizione azide-alchino mostra che essa soddisfa molti dei prerequisiti. La maggior parte dei materiali di partenza, alchini monosostituiti ed azidi organiche, sono disponibili commercialmente, molti altri possono essere sintetizzati con un'ampia varietà di gruppi funzionali, e le loro reazioni di cicloaddizione portano selettivamente a 1,2,3-triazoli.
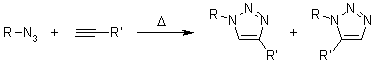 Sfortunatamente, la cicloaddizione 1,3-dipolare di Huigens* di alchini con azidi, promossa termicamente, richiede elevate temperature e spesso produce miscele dei due regioisomeri quando vengono usati alchini asimmetrici. A questo riguardo, la classica cicloaddizione 1,3-dipolare fallisce quale vera reazione click. Una variante catalizzata da rame che segue un diverso meccanismo può essere condotta in condizioni acquose, anche a temperatura ambiente. Inoltre, mentre le classiche cicloaddizioni 1,3-dipolari di Huisgen spesso danno miscele di regioisomeri, la reazione catalizzata da rame permette la sintesi del solo ed unico regioisomero 1,4-disostituito. Al contrario, la più recentemente sviluppata reazione catalizzata da rutenio porta a regioselettività opposti con ma formazione di triazoli 1,5-disostituiti. Quindi, queste reazioni catalizzate rispettano totalmente la definizione di click chemistry ed hanno posto l'attenzione sulla cicloaddizione azide-alchino quale prototipo di reazione click.
Sfortunatamente, la cicloaddizione 1,3-dipolare di Huigens* di alchini con azidi, promossa termicamente, richiede elevate temperature e spesso produce miscele dei due regioisomeri quando vengono usati alchini asimmetrici. A questo riguardo, la classica cicloaddizione 1,3-dipolare fallisce quale vera reazione click. Una variante catalizzata da rame che segue un diverso meccanismo può essere condotta in condizioni acquose, anche a temperatura ambiente. Inoltre, mentre le classiche cicloaddizioni 1,3-dipolari di Huisgen spesso danno miscele di regioisomeri, la reazione catalizzata da rame permette la sintesi del solo ed unico regioisomero 1,4-disostituito. Al contrario, la più recentemente sviluppata reazione catalizzata da rutenio porta a regioselettività opposti con ma formazione di triazoli 1,5-disostituiti. Quindi, queste reazioni catalizzate rispettano totalmente la definizione di click chemistry ed hanno posto l'attenzione sulla cicloaddizione azide-alchino quale prototipo di reazione click.
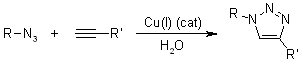
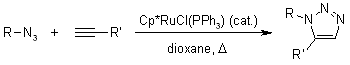 Meccanismo della cicloaddizione 1,3-dipolare di Huisgen azide-alchino
Per questo meccanismo, ci si riferisce alle cicloaddizioni 1,3-dipolari. Questa reazioni è molto esotermica, ma l'elevata barriera di attivazione è responsabile della molto lenta velocità di reazione, anche ad una temperatura elevata. Un altro svantaggio è la formazione di regioisomeri, dato che le due possibili interazioni HOMO-LUMO dei substrati sono strettamente correlate in termini di energia. La reazione termica quindi spesso produce miscela circa 1:1 di regioisomeri sia 1,4- sia 1,5-sostituiti.
Meccanismo della cicloaddizione 1,3-dipolare di Huisgen azide-alchino
Per questo meccanismo, ci si riferisce alle cicloaddizioni 1,3-dipolari. Questa reazioni è molto esotermica, ma l'elevata barriera di attivazione è responsabile della molto lenta velocità di reazione, anche ad una temperatura elevata. Un altro svantaggio è la formazione di regioisomeri, dato che le due possibili interazioni HOMO-LUMO dei substrati sono strettamente correlate in termini di energia. La reazione termica quindi spesso produce miscela circa 1:1 di regioisomeri sia 1,4- sia 1,5-sostituiti.
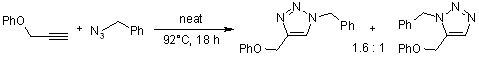 V. V. Rostovtsev, L. G. Green, V. V. Fokin, K. B. Sharpless, Angew. Chem. Int. Ed., 2002, 41, 2596-2599.
Meccanismo della cicloaddizione azide-alchino catalizzata da rame (CuAAC)
Quale migliore reazione click di sempre, la cicloaddizione azide-alchino catalizzata da rame si caratterizza per un enorme accelerazione della velocità, 107-108, comprata alla cicloaddizione 1,3-dipolare non catalizzata. Essa avviene entro un vasto range di temperature, è insensibile alle condizioni acquose e ad un range di pH compreso tra 4 e 12, e tollera un vasto range di gruppi funzionali. I prodotti puri possono essere isolati tramite semplice filtrazione o estrazione senza il bisogno di cromatografia o ricristallizzazione.
V. V. Rostovtsev, L. G. Green, V. V. Fokin, K. B. Sharpless, Angew. Chem. Int. Ed., 2002, 41, 2596-2599.
Meccanismo della cicloaddizione azide-alchino catalizzata da rame (CuAAC)
Quale migliore reazione click di sempre, la cicloaddizione azide-alchino catalizzata da rame si caratterizza per un enorme accelerazione della velocità, 107-108, comprata alla cicloaddizione 1,3-dipolare non catalizzata. Essa avviene entro un vasto range di temperature, è insensibile alle condizioni acquose e ad un range di pH compreso tra 4 e 12, e tollera un vasto range di gruppi funzionali. I prodotti puri possono essere isolati tramite semplice filtrazione o estrazione senza il bisogno di cromatografia o ricristallizzazione.
 F. Himo, T. Lovell, R. Hilgraf, V. V. Rostovtsev, L. Noodleman, K. B. Sharpless, V. V. Fokin, J. Am. Chem. Soc., 2005, 127, 210-216.
Il catalizzatore attivo di Cu(I) può essere generato da sali di Cu(I) o Cu(II) usando sodio ascorbato quale agente riducente. L'aggiunta di un leggero eccesso di sodio ascorbato previene la formazione dei prodotti di omocoupling ossidativo. Può anche essere impegato il disproporzionamento di un sale di Cu(II) in presenza di un filo di Cu(0) per formare la specie attiva di Cu(I).
Calcoli DFT hanno mostrato che la coordinazione del Cu(I) con l'alchino è leggermente endotermica in MeCN, ma esotermica in acqua, che è in accordo con una accelerazione della velocità osservata in acqua. Comunque, la coordinazione del Cu con l'acetilene non accelera una cicloaddizione 1,3-dipolare. Un tale processo è stato calcolato essere meno favorito rispetto alla cicloaddizione 1,3-dipolare non catalizzata. Invece, si forma un acetiluro di rame, ed in seguito l'azide sostituisce un altro ligando legandosi al rame. Quindi, si forma un insolito metallaciclo di rame(III) a sei membri. La barriera per questo processo è stata calcolata essere considerabilmente più bassa rispetto alla reazione non catalizzata. La velocità calcolata a temperatura ambiente è di 1 s-1, che è abbastanza ragionevole. La contrazione d'anello a dare un triazolil-rame derivato è seguita da protonolisi che porta al prodotto, un triazolo, e chiude il ciclo catalitico.
F. Himo, T. Lovell, R. Hilgraf, V. V. Rostovtsev, L. Noodleman, K. B. Sharpless, V. V. Fokin, J. Am. Chem. Soc., 2005, 127, 210-216.
Il catalizzatore attivo di Cu(I) può essere generato da sali di Cu(I) o Cu(II) usando sodio ascorbato quale agente riducente. L'aggiunta di un leggero eccesso di sodio ascorbato previene la formazione dei prodotti di omocoupling ossidativo. Può anche essere impegato il disproporzionamento di un sale di Cu(II) in presenza di un filo di Cu(0) per formare la specie attiva di Cu(I).
Calcoli DFT hanno mostrato che la coordinazione del Cu(I) con l'alchino è leggermente endotermica in MeCN, ma esotermica in acqua, che è in accordo con una accelerazione della velocità osservata in acqua. Comunque, la coordinazione del Cu con l'acetilene non accelera una cicloaddizione 1,3-dipolare. Un tale processo è stato calcolato essere meno favorito rispetto alla cicloaddizione 1,3-dipolare non catalizzata. Invece, si forma un acetiluro di rame, ed in seguito l'azide sostituisce un altro ligando legandosi al rame. Quindi, si forma un insolito metallaciclo di rame(III) a sei membri. La barriera per questo processo è stata calcolata essere considerabilmente più bassa rispetto alla reazione non catalizzata. La velocità calcolata a temperatura ambiente è di 1 s-1, che è abbastanza ragionevole. La contrazione d'anello a dare un triazolil-rame derivato è seguita da protonolisi che porta al prodotto, un triazolo, e chiude il ciclo catalitico.
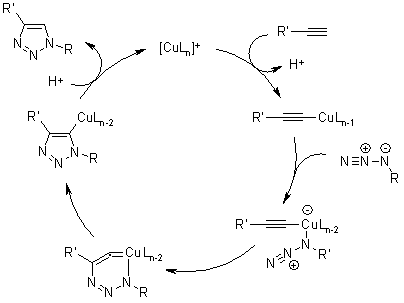 F. Himo, T. Lovell, R. Hilgraf, V. V. Rostovtsev, L. Noodleman, K. B. Sharpless, V. V. Fokin, J. Am. Chem. Soc., 2005, 127, 210-216.
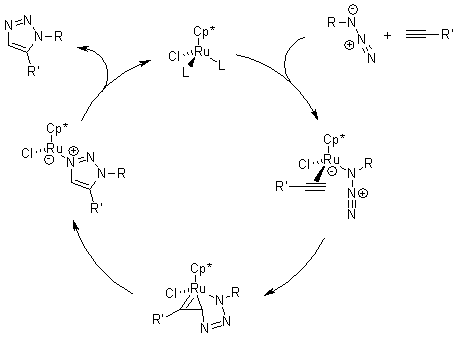
Meccanismo della cicloaddizione azide-alchino catalizzata da rutenio (RuAAC)
La ricerca di un catalizzatore nuovo rivelò che i pentametilciclopentadienil rutenio cloruro [Cp*RuCl] complessi sono in grado di catalizzare la cicloaddizione di azidi e alchini terminali regioselettivamente portando così a 1,2,3-triazoli 1,5-disostituiti. Inoltre, le RuAAC possono essere usate anche con alchini interni, fornendo così 1,2,3-triazoli completamente sostituiti, diveramente da quanto accade con le CuAAC.
F. Himo, T. Lovell, R. Hilgraf, V. V. Rostovtsev, L. Noodleman, K. B. Sharpless, V. V. Fokin, J. Am. Chem. Soc., 2005, 127, 210-216.
Meccanismo della cicloaddizione azide-alchino catalizzata da rutenio (RuAAC)
La ricerca di un catalizzatore nuovo rivelò che i pentametilciclopentadienil rutenio cloruro [Cp*RuCl] complessi sono in grado di catalizzare la cicloaddizione di azidi e alchini terminali regioselettivamente portando così a 1,2,3-triazoli 1,5-disostituiti. Inoltre, le RuAAC possono essere usate anche con alchini interni, fornendo così 1,2,3-triazoli completamente sostituiti, diveramente da quanto accade con le CuAAC.
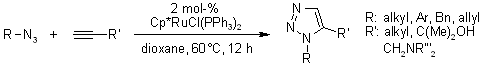
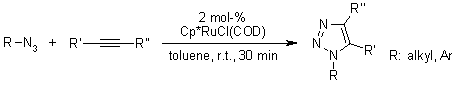 B. C. Boren, S. Narayan, L. K. Rasmussen, L. Zhang, H. Zhao, Z. Lin, G. Jia, V. V. Fokin, J. Am. Chem. Soc., 2008, 130, 8923-8930.
La RuAAC pare procedere attraverso un coupling ossidativo dell'azide e dell'alchino a dare un rutenaciclo a sei membri, in cui il primo nuovo legame carbonio-azoto è formato tra il carbonio più elettronegativo dell'alchino e l'azoto terminale, elettrofilo dell'azide. Questo passaggio è seguito da eliminazione riduttiva, che forma il triazolo. Calcoli DFT supportano questa proposta meccanicistica e indicano che lo step di eliminazione riduttiva è quello rate-determining.
B. C. Boren, S. Narayan, L. K. Rasmussen, L. Zhang, H. Zhao, Z. Lin, G. Jia, V. V. Fokin, J. Am. Chem. Soc., 2008, 130, 8923-8930.
La RuAAC pare procedere attraverso un coupling ossidativo dell'azide e dell'alchino a dare un rutenaciclo a sei membri, in cui il primo nuovo legame carbonio-azoto è formato tra il carbonio più elettronegativo dell'alchino e l'azoto terminale, elettrofilo dell'azide. Questo passaggio è seguito da eliminazione riduttiva, che forma il triazolo. Calcoli DFT supportano questa proposta meccanicistica e indicano che lo step di eliminazione riduttiva è quello rate-determining.
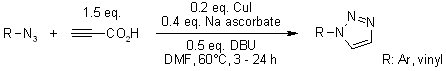
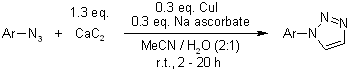
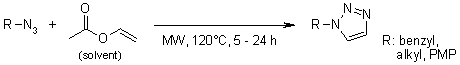
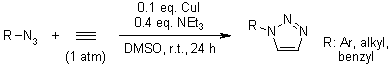

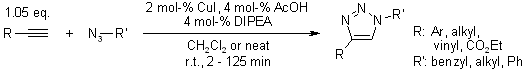
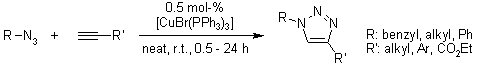
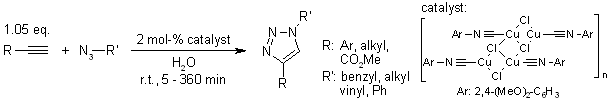
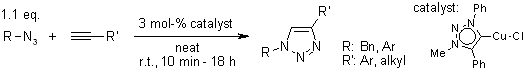
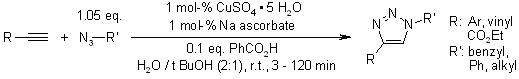
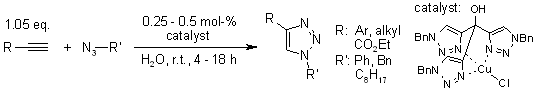
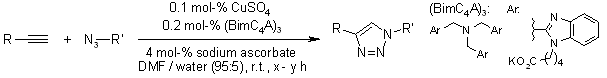 V. O. Rodionov, S. I. Presolski, S. Gardinier, Y.-H. Lim, M. G. Finn, J. Am. Chem. Soc., 2007, 129, 12696-12704.
Cicloaddizione 1,3-dipolare di azidi organiche ed alchini tramite un dirame silicotungstato sostituito
V. O. Rodionov, S. I. Presolski, S. Gardinier, Y.-H. Lim, M. G. Finn, J. Am. Chem. Soc., 2007, 129, 12696-12704.
Cicloaddizione 1,3-dipolare di azidi organiche ed alchini tramite un dirame silicotungstato sostituito
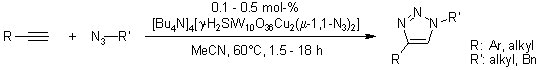 K. Kamata, Y. Nakagawa, K. Yamaguchi, N. Mizuno, J. Am. Chem. Soc., 2008, 130, 15304-15310.
Un catalizzatore eterogeneo di rame per la cicloaddizione di azidi ed alchini senza additivi in condizioni ambiente
K. Kamata, Y. Nakagawa, K. Yamaguchi, N. Mizuno, J. Am. Chem. Soc., 2008, 130, 15304-15310.
Un catalizzatore eterogeneo di rame per la cicloaddizione di azidi ed alchini senza additivi in condizioni ambiente
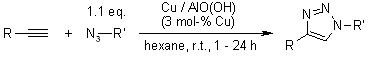 I. S. Park, M. S. Kwon, Y. Kim, J. S. Lee, J. Park, Org. Lett., 2008, 10, 497-500.
Click Chemistry catalizzata dall'eterogeneo Cu/C
I. S. Park, M. S. Kwon, Y. Kim, J. S. Lee, J. Park, Org. Lett., 2008, 10, 497-500.
Click Chemistry catalizzata dall'eterogeneo Cu/C
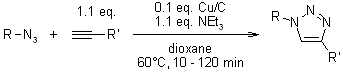 B. H. Lipshutz, B. R. Taft, Angew. Chem. Int. Ed., 2006, 45, 8235-8238.
Un processo di cicloaddizione di Huisgen graduale: legame regioselettivo catalizzato da rame(I) di azidi ed alchini terminali
B. H. Lipshutz, B. R. Taft, Angew. Chem. Int. Ed., 2006, 45, 8235-8238.
Un processo di cicloaddizione di Huisgen graduale: legame regioselettivo catalizzato da rame(I) di azidi ed alchini terminali
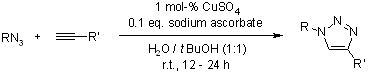 V. V. Rostovtsev, L. G. Green, V. V. Fokin, K. B. Sharpless, Angew. Chem. Int. Ed., 2002, 41, 2596-2599.
Sintesi regioselettiva di 1,2,3-triazoli tramite l'uso di un catalizzatore di rame(I) supportato su silice
V. V. Rostovtsev, L. G. Green, V. V. Fokin, K. B. Sharpless, Angew. Chem. Int. Ed., 2002, 41, 2596-2599.
Sintesi regioselettiva di 1,2,3-triazoli tramite l'uso di un catalizzatore di rame(I) supportato su silice
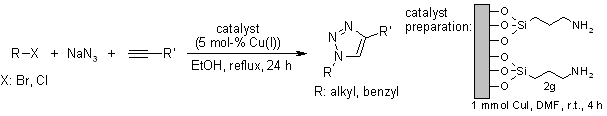 T. Miaoa, L. Wang, Synthesis, 2008, 363-368.
Efficace conversione di amine aromatiche in azidi: Un sintesi one-pot di collegamenti tra triazoli
T. Miaoa, L. Wang, Synthesis, 2008, 363-368.
Efficace conversione di amine aromatiche in azidi: Un sintesi one-pot di collegamenti tra triazoli
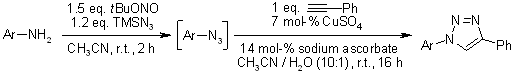 K. Barral, A. D. Moorhouse, J. E. Moses, Org. Lett., 2007, 9, 1809-1811.
Sintesi one-pot in tre passaggi di 1,2,3-triazoli tramite cicloaddizione catalizzata da rame di azidi con alchini formati tramite cross-coupling di Sonogashira e desililazione
K. Barral, A. D. Moorhouse, J. E. Moses, Org. Lett., 2007, 9, 1809-1811.
Sintesi one-pot in tre passaggi di 1,2,3-triazoli tramite cicloaddizione catalizzata da rame di azidi con alchini formati tramite cross-coupling di Sonogashira e desililazione
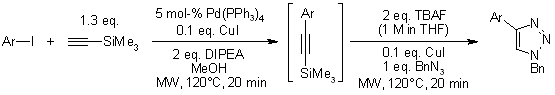 F. Friscourt, G.-J. Boons, Org. Lett., 2010, 12, 4936-4939.
Conversione catalizzata da rame(II) di acidi aril/eteroaril boronici, boronati, e trifluoroborati nella corrispondenti azidi: Scopo e limitazioni del substrato
F. Friscourt, G.-J. Boons, Org. Lett., 2010, 12, 4936-4939.
Conversione catalizzata da rame(II) di acidi aril/eteroaril boronici, boronati, e trifluoroborati nella corrispondenti azidi: Scopo e limitazioni del substrato
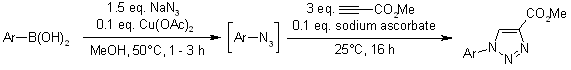 K. D. Grimes, A. Gupte, C. C. Aldrich, Synthesis, 2010, 1441-1448.
Cicloaddizione catalizzata da rutenio di aril azidi ed alchini
K. D. Grimes, A. Gupte, C. C. Aldrich, Synthesis, 2010, 1441-1448.
Cicloaddizione catalizzata da rutenio di aril azidi ed alchini
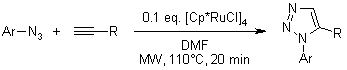 L. K. Rasmussen, B. C. Boren, V. V. Fokin, Org. Lett., 2007, 9, 5337-5339.
Efficace sintesi one-pot di 6-[(1H-1,2,3-triazol-1-il)metil]uracili polisostituiti tramite protocollo "click"
L. K. Rasmussen, B. C. Boren, V. V. Fokin, Org. Lett., 2007, 9, 5337-5339.
Efficace sintesi one-pot di 6-[(1H-1,2,3-triazol-1-il)metil]uracili polisostituiti tramite protocollo "click"
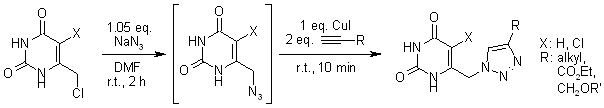 P. Jansa, P. Špaček, I. Votruba, P. Břehová, M. Dračínský, B. Klepetářová, Z. Janeba, Collect. Czech. Chem. Commun., 2011, 13, 1121-1131.
P. Jansa, P. Špaček, I. Votruba, P. Břehová, M. Dračínský, B. Klepetářová, Z. Janeba, Collect. Czech. Chem. Commun., 2011, 13, 1121-1131.
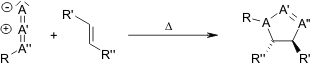
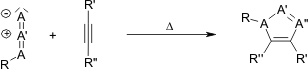
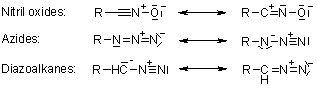
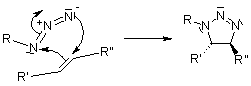
 , porta a regioisomeri:
, porta a regioisomeri: