LuiCap
2016-11-15 10:38
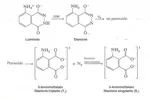
In questo esperimento viene utilizzato il luminolo (5-amminoftalidrazide).
In soluzione neutra la maggior parte del luminolo si trova nella forma dipolare (zwitterione) e mostra, per esposizione alla luce, una debole fluorescenza blu. In soluzione basica però il luminolo passa alla forma dianionica, che viene ossidata dall'ossigeno molecolare prodotto in situ dalla decomposizione dell'acqua ossigenata in ambiente basico, secondo la seguente reazione di ossidoriduzione:
semi ox H2O2(aq) + 2 OH- --> O2(g) + 2 H2O(l) + 2 e-
semi red H2O2(aq) + 2 e- --> 2 H2O(l) + 2 OH-
redox H2O2(aq) --> ½ O2(g) + 2 H2O(l)
La reazione è catalizzata dagli ioni ferrici contenuti nella soluzione di ferricianuro di potassio (o potassio esacianoferrato(III)), K3[Fe(CN)6].
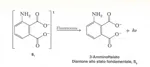
Il dianione del luminolo reagisce con l'ossigeno molecolare per dare un perossido che si decompone con sviluppo di azoto e formazione del dianione del 3-amminoftalato elettronicamente eccitato. Quest'ultimo emette un fotone hν che viene percepito come luce.
L'intermedio che emette luce è il singoletto eccitato del dianione 3-amminoftalico: il suo spettro di fluorescenza ottenuto per assorbimento fotonico coincide con lo spettro della luce emessa dalla reazione chemiluminescente.
Lo stato eccitato del dianone 3-amminoftalico può essere spento dalle molecole di un opportuno accettore, oppure la sua energia (circa 50-80 kcal/mol) può essere trasferita a un accettore (un colorante fluorescente) che emetta luce a sua volta.
immagini tratte da:
D.L.Pavia, G.M.Lampman, G.S.Kriz
Il laboratorio di chimica organica
Edizioni Sorbona, Milano, 1994
Strumenti
• 2 matracci tarati da 500 mL
• 1 becher da 1000 mL
• 2 becher da 600 mL
• 1 refrigerante a serpentina
• 1 pinza + 1 morsetto
• 1 asta di sostegno
• imbuti
• vetrini da orologio
• contagocce con gommino
• 1 ancoretta magnetica
• 1 piastra con agitatore magnetico
• bilancia tecnica
Reagenti chimici
• Soluzione A: soluzione acquosa di idrossido di sodio e luminolo: pesare su un vetrino da orologio 5,0 g di idrossido di sodio; pesare su un altro vetrino 1,0 g di luminolo; trasferire il tutto con acqua distillata, lavando i vetrini, dentro ad un matraccio tarato da 500 mL, sciogliere i solidi e portare a volume con acqua distillata.
• Soluzione B: soluzione acquosa di ferricianuro di potassio: pesare su un vetrino da orologio 15,0 g di ferricianuro di potassio; trasferire il tutto con acqua distillata, lavando il vetrino, dentro ad un matraccio tarato da 500 mL, sciogliere il solido e portare a volume con acqua distillata.
• Soluzione di acqua ossigenata al 30% p/v (110 volumi di Ossigeno)
Procedimento
• Introdurre nel becher da 1000 mL un’ancoretta magnetica, una punta di spatola di ferricianuro di potassio solido e collocare il tutto sopra ad una piastra con agitatore magnetico.
• Montare verticalmente sopra al becher il refrigerante a serpentina con un imbuto nell'imboccatura superiore.
• Versare 50 mL della soluzione A dentro a un becher da 600 mL e portare a 400 mL con acqua distillata
• Versare 50 mL della soluzione B dentro a un becher da 600 mL, addizionare 3 mL di acqua ossigenata al 30% e portare a 400 mL con acqua distillata.
• Avviare l’agitatore magnetico.
• Oscurare la stanza.
• Versare contemporaneamente le due soluzioni dall’alto del refrigerante: si osserverà una chemiluminescenza (ossia una emissione di radiazione luminosa prodotta da una reazione chimica) di colore azzurro (che potrei testimoniare con un video... se solo riuscissi a caricarlo  )
)
Grazie Trevize!!!
I seguenti utenti ringraziano LuiCap per questo messaggio: Claudio, luigi_67, TrevizeGolanCz, NaClO, Beefcotto87, Roberto